Naujos publikacijos
Nauji genetiniai mechanizmai galėtų būti gliomos gydymo taikinys
Paskutinį kartą peržiūrėta: 02.07.2025

Visas „iLive“ turinys yra peržiūrėtas medicinoje arba tikrinamas, kad būtų užtikrintas kuo didesnis faktinis tikslumas.
Mes turime griežtas įsigijimo gaires ir susiejamos tik su geros reputacijos žiniasklaidos svetainėmis, akademinių tyrimų institucijomis ir, jei įmanoma, medicininiu požiūriu peržiūrimais tyrimais. Atkreipkite dėmesį, kad skliausteliuose ([1], [2] ir tt) esantys numeriai yra paspaudžiami nuorodos į šias studijas.
Jei manote, kad bet koks mūsų turinys yra netikslus, pasenęs arba kitaip abejotinas, pasirinkite jį ir paspauskite Ctrl + Enter.
Neurologijos katedros Keno ir Ruth Davey Neuroonkologijos skyriaus profesoriaus, daktaro Shi-Yuan Cheng laboratorijos tyrimas nustatė naujus mechanizmus, lemiančius alternatyvius RNR splaisingo atvejus gliomos naviko ląstelėse, kurie gali būti nauji terapiniai taikiniai. Tyrimo rezultatai paskelbti žurnale „ Klinikinių tyrimų žurnalas“.
„Radome kitokį gliomos gydymo būdą, taikydami alternatyvaus splaisingo prizmę, ir atradome naujus taikinius, kurie anksčiau nebuvo nustatyti, bet yra svarbūs gliomos piktybiniams navikams“, – teigė Xiao Song, MD, PhD, neurologijos docentas ir pagrindinis tyrimo autorius.
Gliomos yra labiausiai paplitęs pirminio smegenų auglio tipas suaugusiesiems ir kilęs iš glijos ląstelių, kurios yra centrinėje nervų sistemoje ir palaiko gretimus neuronus. Gliomos yra labai atsparios standartiniam gydymui, įskaitant spindulinę terapiją ir chemoterapiją, dėl naviko genetinio ir epigenetinio heterogeniškumo, todėl reikia rasti naujų terapinių taikinių.
Ankstesni Chengo laboratorijos tyrimai, paskelbti žurnale „Cancer Research“, parodė, kad svarbaus splaisingo faktoriaus SRSF3 kiekis gliomose yra žymiai padidėjęs, palyginti su normaliomis smegenimis, o SRSF3 reguliuojamas RNR splaisingas skatina gliomos augimą ir progresavimą, paveikdamas daugelį ląstelinių procesų naviko ląstelėse.
RNR splaisingas yra procesas, kurio metu pašalinami intronai (nekoduojantys RNR regionai) ir sujungiami egzonai (koduojantys regionai), kad susidarytų brandi mRNR molekulė, palaikanti genų ekspresiją ląstelėje.
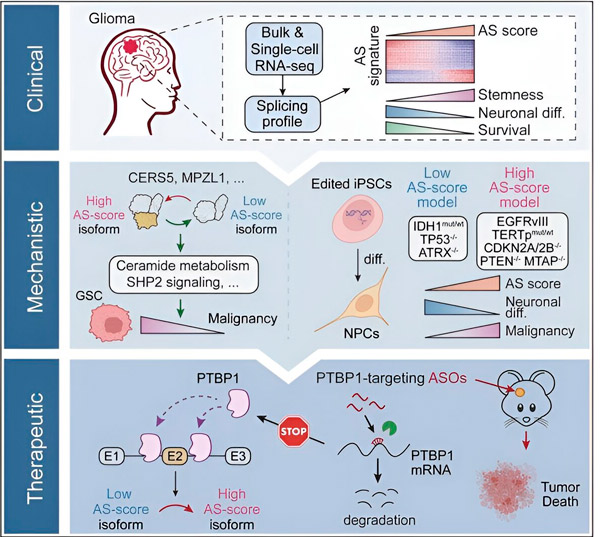
Šiame tyrime mokslininkai siekė nustatyti alternatyvaus splaisingo pokyčius gliomos naviko ląstelėse, šių pokyčių mechanizmus ir nustatyti jų potencialą kaip terapinius taikinius.
Naudodami skaičiavimo metodus ir RNR sekoskaitos technologijas, tyrėjai ištyrė gliomos naviko ląstelių, paimtų iš pacientų mėginių, splaisingo pokyčius. Norėdami patvirtinti šiuos pokyčius, jie panaudojo CRISPR genų redagavimo technologijas, kad į gliomos modelius, gautus iš žmogaus indukuotų pluripotentinių kamieninių ląstelių (iPSC), įvestų skirtingas gliomos vairuotojo mutacijas.
Jie nustatė, kad šiuos splaisingo pokyčius sustiprina epidermio augimo faktoriaus receptoriaus III (EGFRIII) variantas, kuris, kaip žinoma, yra pernelyg ekspresuojamas daugelyje navikų, įskaitant gliomas, ir yra slopinamas IDH1 geno mutacijos.
Tyrėjai patvirtino dviejų RNR splaisingo įvykių, kurie sukuria skirtingas baltymų izoformas su skirtingomis aminorūgščių sekomis, funkciją.
„Tik viena iš šių izoformų gali skatinti naviko augimą, o kita izoforma, kuri paprastai yra ekspresuojama normaliose smegenyse. Augliai išnaudoja šį mechanizmą, kad selektyviai išreikštų naviką skatinančią izoformą, palyginti su normalia smegenų izoforma“, – sakė Song.
Tuomet komanda išanalizavo priešsrovinius RNR jungiančius baltymus ir nustatė, kad PTBP1 genas reguliuoja naviką skatinantį RNR splaisingą gliomos ląstelėse. Naudodami ortotopinės gliomos modelį imunodeficituojančiose pelėse, tyrėjai nukreipė PTBP1 į antisensinių oligonukleotidų (ASO) pagrindu sukurtą terapiją, kuri galiausiai slopino naviko augimą.
„Mūsų duomenys pabrėžia alternatyvaus RNR splaisingo vaidmenį darant įtaką gliomos piktybiškumui ir heterogeniškumui bei jo potencialą kaip terapinį pažeidžiamumą gydant suaugusiųjų gliomas“, – rašė tyrimo autoriai.
Kitas tyrėjų žingsnis – ištirti PTBP1 taikymo potencialą sukelti priešvėžinį imuninį atsaką, sakė Song.
„Naudodami ilgo skaitymo RNR sekoskaitos analizę, nustatėme, kad nukreipus PTBP1 į gliomos ląsteles, susidaro keli alternatyviai sujungti transkriptai, kurių nėra normaliuose audiniuose. Taigi, kitas mūsų projektas yra išsiaiškinti, ar ši izoforma gali generuoti kai kuriuos antigenus, kad imuninė sistema galėtų geriau atpažinti naviką“, – sakė Song.
Song taip pat pridūrė, kad jų komanda yra suinteresuota analizuoti gliomos pacientų ne naviko ląstelių, tokių kaip imuninės ląstelės, splaisingo pokyčius.
„Jau žinome, kad splaisingas yra labai svarbus reguliuojant ląstelės funkciją, todėl jis turėtų reguliuoti ne tik naviko piktybiškumą, bet ir imuninių ląstelių funkciją, siekiant nustatyti, ar jos gali veiksmingai sunaikinti vėžį. Todėl mes taip pat atliekame bioinformatinę analizę su naviko infiltruotomis imuninėmis ląstelėmis, kad pamatytume, ar po to, kai imuninė ląstelė infiltruojasi į naviką, atsiranda splaisingo pokyčių.“
„Mūsų tikslas yra nustatyti alternatyvaus splaisingo vaidmenį formuojant imuninę sistemą slopinančią naviko mikroaplinką ir nustatyti galimus taikinius, skirtus imunoterapijos veiksmingumui glioma gydyti gerinti“, – sakė Song.
