Nauji genetiniai mechanizmai gali suteikti terapinių taikinių prieš gliomą
Paskutinį kartą peržiūrėta: 14.06.2024

Visas „iLive“ turinys yra peržiūrėtas medicinoje arba tikrinamas, kad būtų užtikrintas kuo didesnis faktinis tikslumas.
Mes turime griežtas įsigijimo gaires ir susiejamos tik su geros reputacijos žiniasklaidos svetainėmis, akademinių tyrimų institucijomis ir, jei įmanoma, medicininiu požiūriu peržiūrimais tyrimais. Atkreipkite dėmesį, kad skliausteliuose ([1], [2] ir tt) esantys numeriai yra paspaudžiami nuorodos į šias studijas.
Jei manote, kad bet koks mūsų turinys yra netikslus, pasenęs arba kitaip abejotinas, pasirinkite jį ir paspauskite Ctrl + Enter.
Shi-Yuan Cheng, PhD, Neurologijos katedros Neuro-onkologijos skyriaus profesoriaus, profesoriaus Shi-Yuan Cheng laboratorija atskleidė naujus mechanizmus, kuriais grindžiami alternatyvūs RNR susijungimo reiškiniai gliomos naviko ląstelėse, kurie gali būti naujų terapinių tikslų. Tyrimo rezultatai paskelbti Journal of Clinical Investigation.
„Mes radome kitokį būdą gydyti gliomą naudodami alternatyvų sujungimą ir atradome naujus taikinius, kurie anksčiau nebuvo nustatyti, bet yra svarbūs piktybiniam gliomos augliui. Sakė Xiao Song, medicinos mokslų daktaras, neurologijos docentas ir pagrindinis tyrimo autorius.
Gliomos yra labiausiai paplitęs pirminio suaugusiųjų smegenų auglio tipas, atsirandantis iš glijos ląstelių, kurios yra centrinėje nervų sistemoje ir palaiko netoliese esančius neuronus. Gliomos yra labai atsparios standartiniam gydymui, įskaitant spinduliuotę ir chemoterapiją, dėl genetinio ir epigenetinio naviko nevienalytiškumo, todėl reikia ieškoti naujų gydymo tikslų.
Ankstesni Cheng laboratorijos tyrimai, paskelbti žurnale Cancer Research, parodė, kad svarbus susiliejimo faktorius SRSF3 yra žymiai padidėjęs gliomų atveju, palyginti su normaliomis smegenimis, ir SRSF3 reguliuojamas. RNR sujungimas skatina gliomos augimą ir progresavimą, paveikdamas daugybę ląstelių procesų naviko ląstelėse.
RNR sujungimas yra procesas, apimantis intronų (nekoduojančių RNR sričių) pašalinimą ir egzonų (koduojančių sričių) sujungimą, kad susidarytų subrendusi mRNR molekulė, palaikanti genų ekspresiją ląstelėje.
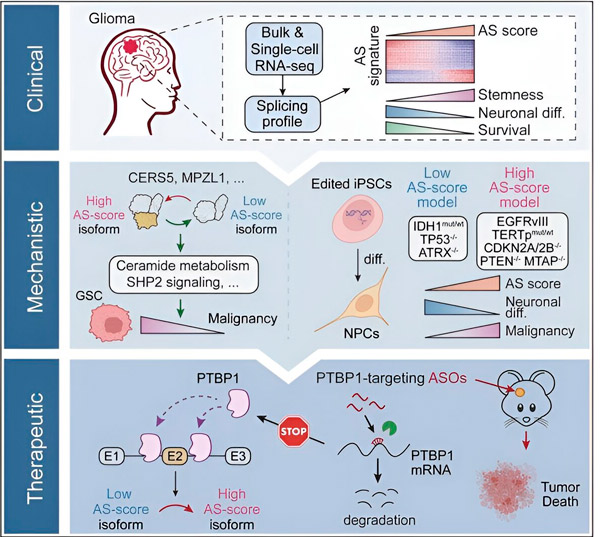
Šiame tyrime mokslininkai siekė nustatyti alternatyvaus gliomos naviko ląstelių sujungimo pokyčius, mechanizmus, kuriais grindžiami šie pokyčiai, ir nustatyti jų, kaip gydymo tikslų, potencialą.
Naudodami skaičiavimo metodus ir RNR sekos nustatymo technologijas, tyrėjai ištyrė gliomos naviko ląstelių sujungimo pokyčius iš pacientų mėginių. Norėdami patvirtinti šiuos pokyčius, jie naudojo CRISPR genų redagavimo technologijas, kad į žmogaus sukeltų pluripotentinių kamieninių ląstelių (iPSC) gautus gliomos modelius įvestų skirtingas gliomos vairuotojų mutacijas.
Jie nustatė, kad šiuos susiliejimo pokyčius sustiprina epidermio augimo faktoriaus receptoriaus III (EGFRIII) variantas, kuris, kaip žinoma, yra pernelyg išreikštas daugelyje navikų, įskaitant gliomas, ir slopinamas IDH1 geno mutacijos. p>
Tyrėjai patvirtino dviejų RNR susijungimo įvykių, kurie sukuria skirtingas baltymų izoformas su skirtingomis aminorūgščių sekomis, funkciją.
"Tik viena iš šių izoformų gali skatinti naviko augimą, o ne kita izoforma, kuri paprastai yra išreikšta normaliose smegenyse. Navikai naudoja šį mechanizmą, kad selektyviai išreikštų naviką skatinančią izoformą, palyginti su normalia smegenų izoforma", Song. Pasakė.
Tada komanda išanalizavo RNR surišančius baltymus ir nustatė, kad PTBP1 genas reguliuoja naviką skatinančios RNR susijungimą gliomos ląstelėse. Naudodami ortotopinį imunodeficito pelės gliomos modelį, tyrėjai taikė PTBP1, taikydami antisensinio oligonukleotido (ASO) terapiją, kuri galiausiai slopino naviko augimą.
Mūsų duomenys pabrėžia alternatyvaus RNR susijungimo vaidmenį darant įtaką gliomos piktybiniam navikui ir nevienalytiškumui bei jo, kaip terapinio pažeidžiamumo suaugusiųjų gliomų gydymui, potencialą“, – rašė tyrimo autoriai.
Tyrėjai planuoja ištirti PTBP1 potencialą, kad būtų sukeltas priešnavikinis imuninis atsakas, sakė Song.
„Naudodami ilgai skaitytą RNR-seq analizę, nustatėme, kad gliomos ląstelėse taikydami PTBP1, susidaro daug alternatyviai sujungtų transkriptų, kurių nėra normaliuose audiniuose. Todėl kitas mūsų projektas yra išsiaiškinti, ar ši izoforma gali generuoti kai kuriuos antigenus“. Kad imuninė sistema galėtų geriau atpažinti naviką“, – sakė Song.
Song taip pat pridūrė, kad jos komanda domisi glioma sergančių pacientų ne naviko ląstelių, pvz., imuninių ląstelių, susiliejimo pokyčių analize.
"Jau žinome, kad sujungimas yra labai svarbus ląstelės funkcijai reguliuoti, todėl jis turėtų ne tik reguliuoti piktybinius navikus, bet ir imuninių ląstelių funkciją, siekiant nustatyti, ar jos gali veiksmingai naikinti vėžį. Taigi mes taip pat atlikti tam tikras bioinformatikos analizes naviko infiltruotose imuninėse ląstelėse, kad išsiaiškintų, ar imuninei ląstelei įsiskverbus į naviką nepasikeitė susijungimas.
Mūsų tikslas yra nustatyti alternatyvaus sujungimo vaidmenį formuojant imuninę sistemą slopinančio naviko mikroaplinką ir nustatyti galimus taikinius, kad būtų pagerintas imunoterapijos veiksmingumas sergant glioma“, – sakė Song.
