Naujos publikacijos
ARID1A geno mutacija daro navikus jautrius imunoterapijai
Paskutinį kartą peržiūrėta: 02.07.2025

Visas „iLive“ turinys yra peržiūrėtas medicinoje arba tikrinamas, kad būtų užtikrintas kuo didesnis faktinis tikslumas.
Mes turime griežtas įsigijimo gaires ir susiejamos tik su geros reputacijos žiniasklaidos svetainėmis, akademinių tyrimų institucijomis ir, jei įmanoma, medicininiu požiūriu peržiūrimais tyrimais. Atkreipkite dėmesį, kad skliausteliuose ([1], [2] ir tt) esantys numeriai yra paspaudžiami nuorodos į šias studijas.
Jei manote, kad bet koks mūsų turinys yra netikslus, pasenęs arba kitaip abejotinas, pasirinkite jį ir paspauskite Ctrl + Enter.
Pastaraisiais metais imunoterapija sukėlė revoliuciją vėžio gydyme. Užuot tiesiogiai taikius į navikus, imunoterapija nukreipia pacientų imuninę sistemą veiksmingiau atakuoti navikus. Tai ypač veiksminga kai kuriems sunkiai gydomiems vėžio tipams. Tačiau mažiau nei pusė visų vėžiu sergančių pacientų reaguoja į dabartinę imunoterapiją, todėl labai reikia nustatyti biožymenis, kurie galėtų numatyti, kuriems pacientams gydymas greičiausiai bus naudingas.
Neseniai mokslininkai pastebėjo, kad pacientai, kurių navikai turi ARID1A geno mutaciją, labiau linkę teigiamai reaguoti į imuninės kontrolės punktų blokadą – imunoterapijos tipą, kuris veikia palaikydamas aktyvuotas su vėžiu kovojančias imunines ląsteles.
Kadangi ARID1A geno mutacija yra daugelyje vėžio rūšių, įskaitant endometriumo, kiaušidžių, kolorektalinį, skrandžio, kepenų ir kasos vėžį, Salko instituto tyrėjai svarstė, kaip tai gali prisidėti prie gydymo jautrumo ir kaip gydytojai galėtų panaudoti šią informaciją, kad suasmenintų vėžio gydymą kiekvienam pacientui.
Jų naujas tyrimas, paskelbtas žurnale „Cell“, rodo, kad ARID1A mutacija padaro navikus jautrius imunoterapijai, pritraukdama prie naviko vėžį kovojančias imunines ląsteles per antivirusinį imuninį atsaką.
Tyrėjai teigia, kad ši mutacija ir antivirusinis imuninis atsakas galėtų būti naudojami kaip biožymuo, siekiant geriau atrinkti pacientus specifinei imunoterapijai, pavyzdžiui, imuninės kontrolės taškų blokadai. Šie rezultatai taip pat skatina kurti vaistus, kurie veikia ARID1A ir susijusius baltymus, kad kiti navikai būtų jautresni imunoterapijai.
„Tai gali išties pakeisti vėžio gydymo rezultatus pacientams“, – teigė vyresnioji tyrimo autorė, docentė Diana Hargreaves. „Pacientai, turintys ARID1A mutaciją, jau turi imuninį atsaką, todėl tereikia sustiprinti šį atsaką imuninės kontrolės blokadomis, kad padėtume jiems sunaikinti savo navikus iš vidaus.“
Nors buvo žinoma, kad žmonės su ARID1A mutacijomis gerai reaguoja į imuninės kontrolės taškų blokadą, tikslus ryšys tarp šių dviejų reiškinių liko neaiškus. Norėdami išsiaiškinti mechanizmą, Salko instituto mokslininkai panaudojo melanomos ir kolorektalinio vėžio pelių modelius su ARID1A mutacija ir funkcionuojančia ARID1A.
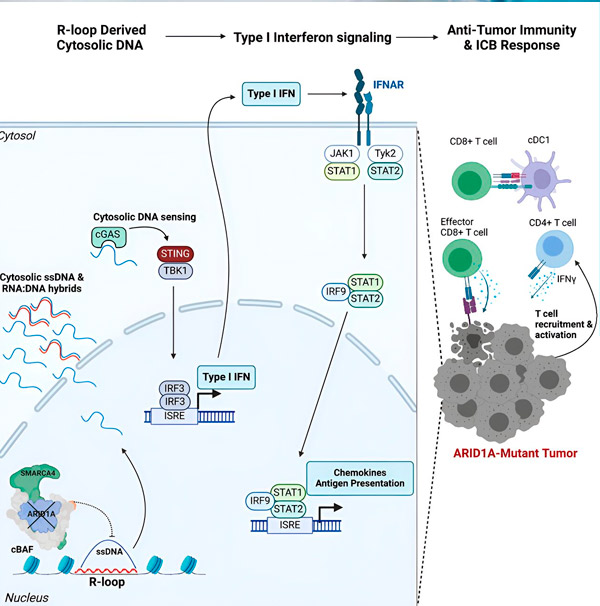
Šaltinis: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
Komanda pastebėjo stiprų imuninį atsaką visuose modeliuose su ARID1A mutacija, bet ne tuose, kuriuose ARID1A veikė, o tai patvirtina idėją, kad ARID1A mutacija iš tiesų sukelia šį atsaką. Tačiau kaip tai veikia molekuliniu lygmeniu?
„Nustatėme, kad ARID1A atlieka svarbų vaidmenį branduolyje, palaikydamas tinkamą DNR organizaciją“, – sako Matthew Maxwell, pirmasis tyrimo autorius ir Hargreaves laboratorijos magistrantas. „Neveikiant ARID1A, laisva DNR gali būti iškirpta ir išleista į citozolį, aktyvuojant pageidaujamą antivirusinį imuninį atsaką, kurį galima sustiprinti imuninės kontrolės taškų blokada.“
ARID1A genas koduoja baltymą, kuris padeda reguliuoti mūsų DNR formą ir palaikyti genomo stabilumą. Kai ARID1A mutuoja, vėžio ląstelėse prasideda Rube'o Goldbergo geną primenanti įvykių grandinė.
Pirma, dėl funkcionuojančio ARID1A trūkumo DNR išsiskiria į citozolį. Citozolinė DNR tada aktyvuoja antivirusinę signalizacijos sistemą – cGAS-STING kelią, nes mūsų ląstelės yra prisitaikiusios pažymėti bet kokią citozolyje esančią DNR kaip svetimą, kad apsisaugotų nuo virusinių infekcijų. Galiausiai cGAS-STING kelias įtraukia imuninę sistemą, kad ši pritrauktų T ląsteles prie naviko ir aktyvuotų jas specializuotomis vėžį žudančiomis T ląstelėmis.
Kiekviename etape, priklausomai nuo ankstesnio, ši įvykių grandinė – ARID1A mutacija, DNR ištrūkimas, cGAS-STING signalizacija, T ląstelių pritraukimas – padidina su vėžiu kovojančių T ląstelių skaičių naviklyje. Imuninės kontrolės taškų blokada gali būti naudojama siekiant užtikrinti, kad šios T ląstelės išliktų aktyvios, sustiprinant jų gebėjimą nugalėti vėžį.
„Mūsų išvados pateikia naują molekulinį mechanizmą, kuriuo ARID1A mutacija gali prisidėti prie priešvėžinio imuninio atsako“, – sako Hargreavesas. „Įdomu tai, kad šie atradimai yra jų transliacinis potencialas. Galime naudoti ARID1A mutacijas, kad atrinktume pacientus imuninės kontrolės taškų blokadai, ir dabar matome mechanizmą, kuriuo vaistai, slopinantys ARID1A arba jo baltymų kompleksą, galėtų būti naudojami imunoterapijai kitiems pacientams dar labiau sustiprinti.“
Aprašydami mechanizmą, kuriuo imuninės kontrolės taškų blokada yra veiksmingesnė ARID1A mutaciją turinčių vėžio atvejų atveju, tyrėjai pateikia klinikų specialistams pagrindą teikti pirmenybę šiai imunoterapijai pacientams, turintiems ARID1A mutaciją. Šie rezultatai yra svarbus žingsnis siekiant pritaikyti vėžio gydymą individualiam gydymui ir įkvepia kurti naujus gydymo būdus, nukreiptus prieš ARID1A ir jo baltymų kompleksą.
Salko instituto komanda tikisi, kad jų išvados pagerins gydymo rezultatus pacientams, sergantiems įvairių tipų vėžiu, susijusiu su ARID1A mutacijomis, ir ketina ištirti šį klinikinį vertimą bendradarbiaudama su Kalifornijos universitetu San Diege.
