Naujos publikacijos
Uždara vaistų tiekimo sistema galėtų pagerinti chemoterapijos pristatymą
Paskutinį kartą peržiūrėta: 02.07.2025

Visas „iLive“ turinys yra peržiūrėtas medicinoje arba tikrinamas, kad būtų užtikrintas kuo didesnis faktinis tikslumas.
Mes turime griežtas įsigijimo gaires ir susiejamos tik su geros reputacijos žiniasklaidos svetainėmis, akademinių tyrimų institucijomis ir, jei įmanoma, medicininiu požiūriu peržiūrimais tyrimais. Atkreipkite dėmesį, kad skliausteliuose ([1], [2] ir tt) esantys numeriai yra paspaudžiami nuorodos į šias studijas.
Jei manote, kad bet koks mūsų turinys yra netikslus, pasenęs arba kitaip abejotinas, pasirinkite jį ir paspauskite Ctrl + Enter.
Kai vėžiu sergantiems pacientams taikoma chemoterapija, daugumos vaistų dozės apskaičiuojamos pagal paciento kūno paviršiaus plotą. Jis įvertinamas naudojant lygtį, kurioje atsižvelgiama į paciento ūgį ir svorį. Ši lygtis buvo suformuluota 1916 m., remiantis vos devynių pacientų duomenimis.
Toks supaprastintas dozavimo metodas neatsižvelgia į kitus veiksnius ir gali lemti, kad pacientui bus skirta per daug arba per mažai vaisto. Dėl to kai kuriems pacientams gali pasireikšti nereikalingas toksinis poveikis arba nepakankamas chemoterapijos veiksmingumas.
Siekdami pagerinti chemoterapijos dozavimo tikslumą, MIT inžinieriai sukūrė alternatyvų metodą, leidžiantį pritaikyti dozę kiekvienam pacientui. Jų sistema matuoja vaisto kiekį paciento organizme ir perduoda šiuos duomenis valdikliui, kuris gali atitinkamai reguliuoti infuzijos greitį.
Šis metodas galėtų padėti kompensuoti vaistų farmakokinetikos skirtumus, kuriuos sukelia kūno sudėjimas, genetinis polinkis, chemoterapijos sukeltas organų toksiškumas, sąveika su kitais vaistais ir maistu bei fermentų, atsakingų už chemoterapinių vaistų skaidymą, cirkadiniai pokyčiai, teigia tyrėjai.
„Pripažindami pažangą suprantant, kaip vaistai metabolizuojami, ir taikydami inžinerinius įrankius, kad supaprastintume individualų dozavimą, manome, kad galime padėti pakeisti daugelio vaistų saugumą ir veiksmingumą“, – teigė Giovanni Traverso, MIT mechanikos inžinerijos docentas, Brighamo ir moterų ligoninės gastroenterologas ir vyresnysis tyrimo autorius.
Louis DeRidder, MIT magistrantas, yra pagrindinis straipsnio, paskelbto žurnale „Med“, autorius.
Nuolatinis stebėjimas
Šiame tyrime tyrėjai daugiausia dėmesio skyrė vaistui, vadinamam 5-fluorouracilu, kuris vartojamas kolorektaliniam vėžiui ir kitoms vėžio rūšims gydyti. Vaistas paprastai skiriamas per 46 valandas, o jo dozė nustatoma pagal formulę, pagrįstą paciento ūgiu ir svoriu, pagal kurią apskaičiuojamas kūno paviršiaus plotas.
Tačiau šis metodas neatsižvelgia į kūno sudėjimo skirtumus, kurie gali turėti įtakos vaisto pasiskirstymui organizme, arba genetinius variantus, kurie turi įtakos jo metabolizmui. Šie skirtumai gali sukelti žalingą šalutinį poveikį, jei skiriama per daug vaisto. Jei vaisto skiriama nepakankamai, jis gali nesunaikinti naviko taip, kaip tikėtasi.
„Žmonės, turintys tą patį kūno paviršiaus plotą, gali turėti labai skirtingą ūgį ir svorį, skirtingą raumenų masę ar skirtingą genetiką, tačiau tol, kol į šią lygtį įjungti ūgis ir svoris rodo tą patį kūno paviršiaus plotą, jų dozė yra identiška“, – sako DeRidderis, medicinos inžinerijos ir medicinos fizikos programos doktorantas Harvardo-MIT sveikatos mokslų ir technologijų programoje.
Kitas veiksnys, galintis bet kuriuo metu pakeisti vaisto kiekį kraujyje, yra cirkadinis fermento, vadinamo dihidropirimidino dehidrogenaze (DPD), kuris skaido 5-fluorouracilą, kiekio svyravimas. DPD, kaip ir daugelio kitų organizmo fermentų, raišką reguliuoja cirkadinis ritmas. Taigi, 5-FU skaidymas DPD pagalba nėra pastovus, o kinta priklausomai nuo paros laiko. Dėl šių cirkadinių ritmų 5-FU kiekis paciento kraujyje infuzijos metu gali skirtis dešimt kartų.
„Naudodami kūno paviršiaus plotą chemoterapijos dozei apskaičiuoti, žinome, kad du žmonės gali patirti labai skirtingą 5-fluorouracilo toksinį poveikį. Vienas pacientas gali turėti gydymo ciklus su minimaliu toksiškumu, o po to ciklą su siaubingu toksiškumu. Kažkas pasikeitė, kaip pacientas metabolizavo chemoterapiją iš vieno ciklo į kitą. Mūsų pasenęs dozavimo metodas neatspindi šių pokyčių, todėl pacientai kenčia“, – sako Douglas Rubinson, klinikinis onkologas Dana-Farber vėžio institute ir šio straipsnio autorius.
Vienas iš būdų kompensuoti chemoterapijos farmakokinetikos kintamumą yra strategija, vadinama terapinio vaisto stebėjimu, kai pacientas duoda kraujo mėginį vieno gydymo ciklo pabaigoje. Išanalizavus šį mėginį dėl vaisto koncentracijos, dozę prireikus galima koreguoti kito ciklo pradžioje (paprastai po dviejų savaičių, jei vartojamas 5-fluorouracilas).
Šis metodas, kaip įrodyta, duoda geresnių rezultatų pacientams, tačiau nebuvo plačiai taikomas chemoterapijai, tokiai kaip 5-fluorouracilas.
MIT tyrėjai norėjo sukurti panašų stebėjimo tipą, tačiau automatizuotu būdu, kuris leistų vaistų dozavimą pritaikyti individualiai realiuoju laiku, o tai galėtų lemti geresnius pacientų rezultatus.
Jų uždarojo ciklo sistemoje vaistų koncentracijas galima nuolat stebėti, o ši informacija naudojama automatiškai koreguoti chemoterapinio vaisto infuzijos greitį, kad dozė būtų palaikoma tiksliniame diapazone.
Ši uždaro ciklo sistema leidžia individualizuoti vaistų dozavimą, atsižvelgiant į vaistus metabolizuojančių fermentų lygio cirkadinį ritmą, taip pat į bet kokius paciento farmakokinetikos pokyčius nuo paskutinio gydymo, pvz., chemoterapijos sukeltą organų toksinį poveikį.
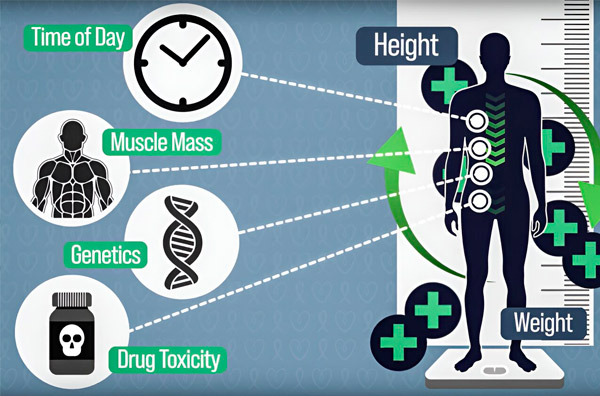
Siekdami tiksliau dozuoti chemoterapiją, MIT inžinieriai sukūrė būdą, kaip nuolat matuoti vaisto kiekį paciento organizme kelių valandų infuzijos metu. Tai padės kompensuoti skirtumus, kuriuos sukelia kūno sudėjimas, genetika, vaistų toksiškumas ir cirkadiniai svyravimai. Šaltinis: Tyrėjų sutikimu.
Naujoji tyrėjų sukurta sistema, žinoma kaip CLAUDIA (angl. Closed-Loop AUtomated Drug Infusion regulAtor), kiekvienam etapui naudoja komerciškai prieinamą įrangą. Kraujo mėginiai imami kas penkias minutes ir greitai paruošiami analizei. Matuojama 5-fluorouracilo koncentracija kraujyje ir palyginama su tiksliniu diapazonu.
Skirtumas tarp tikslinės ir išmatuotos koncentracijų įvedamas į valdymo algoritmą, kuris tada prireikus koreguoja infuzijos greitį, kad dozė būtų palaikoma tokiame koncentracijų diapazone, kuriame vaistas yra veiksmingas ir netoksiškas.
„Sukūrėme sistemą, kuria galime nuolat matuoti vaisto koncentraciją ir atitinkamai koreguoti infuzijos greitį, kad vaisto koncentracija būtų palaikoma terapiniame lange“, – sako DeRidderis.
Greitas reguliavimas
Bandymuose su gyvūnais tyrėjai nustatė, kad naudodami CLAUDIA jie gali palaikyti organizme cirkuliuojančio vaisto kiekį tiksliniame diapazone maždaug 45 procentais laiko.
Gyvūnams, kuriems buvo taikyta chemoterapija be CLAUDIA, vaisto kiekis tiksliniame diapazone išliko vidutiniškai tik 13 procentų laiko. Šiame tyrime tyrėjai netyrė vaisto kiekio veiksmingumo, tačiau manoma, kad koncentracijos palaikymas tiksliniame lange lemia geresnius rezultatus ir mažesnį toksiškumą.
CLAUDIA taip pat sugebėjo palaikyti tikslinę 5-fluorouracilo dozę net ir tada, kai buvo skiriamas vaistas, slopinantis DPD fermentą. Gyvūnams, kuriems šis inhibitorius buvo skirtas be nuolatinės stebėsenos ir dozės koregavimo, 5-fluorouracilo kiekis padidėjo iki aštuonių kartų.
Šiai demonstracijai tyrėjai rankiniu būdu atliko kiekvieną proceso etapą naudodami standartinę įrangą, tačiau dabar planuoja automatizuoti kiekvieną žingsnį, kad stebėjimas ir dozės koregavimas būtų atliekami be žmogaus įsikišimo.
Vaistų koncentracijoms matuoti tyrėjai naudojo efektyviąją skysčių chromatografijos-masių spektrometrijos (HPLC-MS) metodą, kuris gali būti pritaikytas beveik bet kokio tipo vaistams aptikti.
„Matome ateitį, kai galėsime naudoti CLAUDIA bet kokiam vaistui, turinčiam tinkamas farmakokinetines savybes ir aptinkamam HPLC-MS metodu, o tai leis pritaikyti individualų daugelio skirtingų vaistų dozavimą“, – sako DeRidderis.
