Medicinos ekspertas
Naujos publikacijos
Įprastas persileidimas - priežastys
Paskutinį kartą peržiūrėta: 04.07.2025

Visas „iLive“ turinys yra peržiūrėtas medicinoje arba tikrinamas, kad būtų užtikrintas kuo didesnis faktinis tikslumas.
Mes turime griežtas įsigijimo gaires ir susiejamos tik su geros reputacijos žiniasklaidos svetainėmis, akademinių tyrimų institucijomis ir, jei įmanoma, medicininiu požiūriu peržiūrimais tyrimais. Atkreipkite dėmesį, kad skliausteliuose ([1], [2] ir tt) esantys numeriai yra paspaudžiami nuorodos į šias studijas.
Jei manote, kad bet koks mūsų turinys yra netikslus, pasenęs arba kitaip abejotinas, pasirinkite jį ir paspauskite Ctrl + Enter.
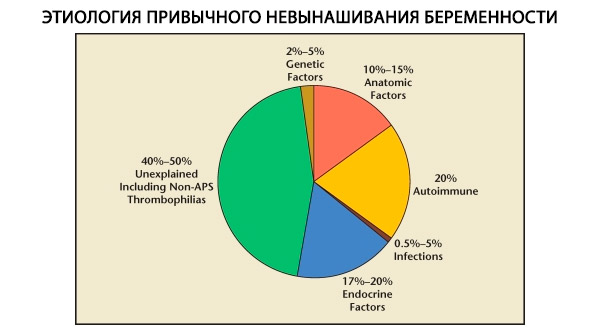
Įprastų persileidimų struktūroje išskiriami genetiniai, anatominiai, endokrininiai, imunologiniai ir infekciniai veiksniai. Atmetus visas minėtas priežastis, lieka grupė pacienčių, kurioms įprastų persileidimų kilmė neaiški (idiopatiniai persileidimai). Pasak C. Coulam ir kt. (1996), 80 % idiopatinių persileidimų yra pagrįsti nenustatytais imuniniais sutrikimais.
Nėra įtikinamų įrodymų, kad endometriozė sukelia pasikartojančius persileidimus arba kad medikamentinis ar chirurginis endometriozės gydymas sumažina pasikartojančių persileidimų dažnį.
Pagal dabartines koncepcijas, be genetinių ir iš dalies infekcinių priežasčių, lemiančių nenormalaus embriono susidarymą, žalingo kitų veiksnių (anatominių, endokrininių, imunologinių) poveikio įgyvendinimas susideda iš nepalankaus fono genetiškai pilnai apvaisinto kiaušinėlio vystymuisi sukūrimo, dėl kurio išeikvojamas choriono rezervinis pajėgumas ir nutrūksta vystymasis (embriogenezė). Kritiniai laikotarpiai pirmąjį nėštumo trimestrą yra 6–8 savaitės (embriono žūtis) ir 10–12 savaitės (apvaisinto kiaušinėlio išstūmimas).
 [ 1 ]
[ 1 ]
Genetinės įprastinio persileidimo priežastys
Genetiniai veiksniai sudaro 3–6 % įprastinio persileidimo priežasčių. Sporadiškai nutraukiant nėštumą pirmąjį trimestrą, apie 50 % abortų yra chromosomų anomalijų. Dauguma jų (95 %) yra chromosomų skaičiaus pokyčiai – monosomija (vienos chromosomos netekimas), trisomija (papildomos chromosomos buvimas), atsirandantys dėl mejozės klaidų, taip pat poliploidija (chromosomų sudėties padidėjimas dėl viso haploidinio rinkinio), kuri atsiranda, kai kiaušinėlį apvaisina du ar daugiau spermatozoidų. Sporadiškais persileidimais dažniausiai pasitaiko trisomija – 60 % visų mutacijų (dažniausiai 16 chromosomoje, taip pat 13, 18, 21, 22 chromosomoje), antroje vietoje pagal dažnį yra Šereševskio-Turnerio sindromas (45 X0 chromosoma) – 20 %, likusius 15 % lemia poliploidija (ypač triploidija).
Jei aborto metu pasikeičia chromosomų skaičius, tėvų kariotipo tyrimas dažniausiai neatskleidžia jokios patologijos, o vaisiaus chromosomų ligos tikimybė kito nėštumo metu yra 1 %. Priešingai, tiriant abortus poroms, turinčioms įprastinį persileidimą, 3–6 % atvejų stebimi struktūriniai chromosomų pokyčiai (intrachromosominiai ir tarpchromosominiai). Tiriant tėvų kariotipą, subalansuoti chromosomų pertvarkymai nustatomi 7 % atvejų. Dažniausiai tai abipusės translokacijos, kai vienos chromosomos segmentas yra kito nehomologinės chromosomos segmento vietoje, taip pat lytinių chromosomų mozaicizmas, inversija ir chromosomų aptikimas žiedo pavidalu. Esant tokiems pertvarkymams vienam iš sutuoktinių, mejozės metu sutrinka chromosomų poravimosi ir atsiskyrimo procesai, dėl ko gametose prarandamos (ištrinamos) arba padvigubėja (duplikuojasi) chromosomų dalys. Dėl to susidaro vadinamieji nesubalansuoti chromosomų pertvarkymai, kai embrionas yra arba negyvybingas, arba yra sunkios chromosomų patologijos nešiotojas. Tikimybė susilaukti vaiko su nesubalansuotomis chromosomų anomalijomis, esant subalansuotiems chromosomų pertvarkymams vieno iš tėvų kariotipe, yra 1–15 %. Duomenų skirtumai susiję su pertvarkymų pobūdžiu, pažeistų segmentų dydžiu, nešiotojo lytimi ir šeimos anamneze.
Diagnostika
Anamnezė
- Paveldimos ligos šeimos nariams.
- Įgimtų anomalijų buvimas šeimoje.
- Vaikų su protiniu atsilikimu gimimas.
- Nevaisingumo ir (arba) nežinomos kilmės persileidimo buvimas susituokusioje poroje ar giminaičiuose.
- Neaiškių perinatalinio mirtingumo atvejų buvimas.
Specialūs tyrimo metodai
- Tėvų kariotipo tyrimas ypač rekomenduojamas susituokusioms poroms, gimus naujagimiui su vystymosi defektais, be persileidimo istorijos, taip pat įprastinio persileidimo atvejais ankstyvosiose nėštumo stadijose.
- Citogenetinė abortų analizė negyvagimio ar naujagimių mirtingumo atvejais.
Indikacijos konsultacijai su kitais specialistais
Jei tėvams nustatomi kariotipo pokyčiai, būtina konsultuotis su genetiku, kad būtų įvertintas vaiko, turinčio patologiją, rizikos laipsnis arba, jei reikia, nuspręsta dėl kiaušinėlio ar spermos donorystės klausimo.
Tolesnis paciento gydymas
Jei susituokusi pora turi patologinį kariotipą, net ir vienam iš tėvų, nėštumo metu rekomenduojama atlikti prenatalinę diagnostiką – chorioninę biopsiją arba amniocentezę – dėl didelės vaisiaus vystymosi sutrikimų rizikos.
Anatominės įprasto persileidimo priežastys
Anatominės įprasto persileidimo priežastys yra šios:
- įgimtos gimdos vystymosi anomalijos (visiškas gimdos padvigubėjimas; dviragė, balno formos, vienaragė gimda; dalinė arba visa gimdos pertvara);
- įgyti anatominiai defektai;
- intrauterininiai sukibimai (Ashermano sindromas);
- submukoziniai gimdos fibroidai;
- isteminis-gimdos kaklelio nepakankamumas.
Anatominių anomalijų dažnis pacienčių, patyrusių įprastinį persileidimą, svyruoja nuo 10 iki 16 %. Gimdos malformacijų, galinčių sukelti persileidimą (bet ne nevaisingumą), dažnis, palyginti su visomis gimdos malformacijomis, yra toks: dviragė gimda – 37 %, balno formos gimda – 15 %, gimdos pertvara – 22 %, visiškas gimdos dvigubėjimas – 11 %, vienaragė gimda – 4,4 %.
Įprasto persileidimo diagnozė
Anamnezė
Esant gimdos anatominei patologijai, dažniau stebimi vėlyvieji nėštumo nutraukimai ir priešlaikiniai gimdymai, tačiau implantuojant ant gimdos pertvaros arba šalia miomatinio mazgo, taip pat galimi ankstyvi nėštumo nutraukimai.
Isthminio-gimdos kaklelio nepakankamumo atveju patognomoninis požymis yra savaiminis nėštumo nutraukimas antrąjį trimestrą arba ankstyvas priešlaikinis gimdymas, kuris įvyksta gana greitai ir be skausmo.
Esant gimdos apsigimimams, būtina atkreipti dėmesį į anamnezinius šlapimo takų patologijos požymius (dažnai lydinčius įgimtas gimdos anomalijas) ir menstruacinės funkcijos vystymosi pobūdį (hematometros su veikiančiu rudimentiniu gimdos ragu požymius).
Specialūs tyrimo metodai
- Šiuo metu diagnozei nustatyti atliekama histerosalpingografija, kurios metu galima ištirti gimdos ertmės formą, nustatyti submukozinių fibromų, sąaugų, pertvarų buvimą ir nustatyti kiaušintakių praeinamumą. Norint diagnozuoti gimdos patologiją, histerosalpingografiją racionalu atlikti laikotarpiu tarp menstruacijų ir ovuliacijos, t. y. pirmoje menstruacinio ciklo fazėje, nutraukus kraujingas išskyras (7–9 ciklo dieną). Norint diagnozuoti gimdos kaklelio nepakankamumą, tyrimas atliekamas antroje menstruacinio ciklo fazėje (18–20 dieną), siekiant nustatyti gimdos kaklelio vidinių angų būklę. Prieš atliekant histerosalpingografiją, būtina atmesti dubens organų uždegimines ligas arba jas gydyti.
- Pastaraisiais metais histeroskopija tapo plačiai paplitusi ir tapo auksiniu standartu diagnozuojant intrauterininę patologiją. Tačiau dėl didesnės kainos, palyginti su histerosalpingografija, šis metodas naudojamas moterims, kurioms, remiantis preliminariais ultragarso duomenimis, nustatyta intrauterininė patologija. Histeroskopijos metu galima ištirti gimdos ertmę, nustatyti intrauterininės patologijos pobūdį ir, jei yra reikiama įranga (rezektoskopas), atlikti minimaliai invazinį chirurginį gydymą – pašalinti sąaugas, submukozinius miomos mazgus ir endometriumo polipus. Šalinant intrauterininę pertvarą, pirmenybė teikiama histerorezektoskopijai su laparoskopine kontrole, kuri apsaugo nuo gimdos sienelės perforacijos galimybės.
- Ultragarsas atliekamas pirmoje menstruacinio ciklo fazėje, kuri leidžia preliminariai diagnozuoti submukozinę gimdos miomą, intrauterininius sąaugius, o antroje ciklo fazėje – nustatyti intrauterininę pertvarą ir dviragę gimdą. Šis metodas ypač svarbus ankstyvosiose nėštumo stadijose, kai jo jautrumas diagnozuojant šias būkles yra 100 %, o specifiškumas – 80 %. Ne nėštumo metu diagnozei reikalingas papildomas patvirtinimas kitais metodais.
- Užsienio autoriai atkreipia dėmesį į sonohisterografijos (ultragarso tyrimas transvaginaliniu jutikliu, prieš tai įvedant į gimdos ertmę 0,9% natrio chlorido tirpalo) pranašumą, palyginti su histerosalpingografija, nes ji leidžia diferencijuoti gimdos pertvaros ir dviragės gimdos diagnostiką. Sonohisterografijos metu galima ne tik ištirti gimdos ertmės formą, bet ir nustatyti gimdos kūno dugno konfigūraciją. Mūsų šalyje šis metodas nėra plačiai paplitęs.
- Kai kuriais sudėtingais atvejais diagnozei patvirtinti naudojamas dubens organų MRT. Šis metodas leidžia gauti vertingos informacijos apie gimdos vystymosi anomalijas, susijusias su netipišku organų išsidėstymu dubenyje. MRT yra svarbus esant rudimentiniam gimdos ragui, siekiant nuspręsti, ar tikslinga jį pašalinti. Poreikis pašalinti rudimentinį gimdos ragą atsiranda, jei jis yra sujungtas su kiaušintakiu ir kiaušide, siekiant užkirsti kelią apvaisinto kiaušinėlio formavimuisi ir vystymuisi jame. Nėštumo nutraukimas esant anatominėms gimdos anomalijoms gali būti susijęs su nesėkmingu apvaisinto kiaušinėlio implantavimu (ant gimdos pertvaros, šalia submukozinio miomos mazgo), nepakankamai išsivysčiusia endometriumo vaskuliarizacija ir priėmimu, glaudžiais erdviniais ryšiais gimdos ertmėje (pavyzdžiui, esant ertmės deformacijai dėl miomos mazgo), dažnai lydima intrauterininės intrakranijinės infekcijos (IKI), ir hormoniniais sutrikimais.
Įprasto persileidimo gydymas
Chirurginis gydymas
Esant intrauterininei pertvarai, submukoziniams miomos mazgams ir sąaugoms, veiksmingiausias chirurginis gydymas yra histerorezektoskopija. Šios grupės moterų vėlesnių persileidimų dažnis po gydymo yra 10 %, palyginti su 90 % prieš operaciją. Lygindamas metroplastikos, atliktos laparotomijos ir transcervikalinės histerorezektoskopijos būdu, rezultatus, P. Heinonen (1997) gavo rezultatus, rodančius mažesnę traumą ir didesnį histerorezektoskopijos efektyvumą; nėštumų, pasibaigusių gyvybingų vaikų gimimu, procentas buvo atitinkamai 68 ir 86 %.
Chirurginis gimdos pertvaros, sąaugų ir submukozinių miomos mazgų pašalinimas 70–80 % atvejų panaikina persileidimą. Tačiau šis metodas neveiksmingas moterims, turinčioms gimdos apsigimimų ir kurios gimdė normaliai, o vėliau pasikartojo persileidimai. Tikėtina, kad tokiais atvejais anatominis veiksnys nėra pagrindinė persileidimo priežastis, todėl būtina ieškoti kitų persileidimo priežasčių.
Įrodyta, kad pilvo metroplastika yra susijusi su didele pooperacinio nevaisingumo rizika ir nepagerina vėlesnio nėštumo prognozės. Todėl geriau teikti pirmenybę histeroskopijai ir laparoskopinėms operacijoms.
Narkotikų gydymas
Spirualės įvedimo, didelių estrogeninių vaistų dozių, Foley kateterio įvedimo į gimdos ertmę po operacijų, skirtų sąaugoms pašalinti, intrauterininei pertvarai, veiksmingumas nebuvo įrodytas. Nėštumą rekomenduojama planuoti ne anksčiau kaip po 3 mėnesių po operacijos. Siekiant pagerinti endometriumo augimą, ciklinė hormonų terapija atliekama 3 menstruacinius ciklus [14]. 3 mėnesius per pirmąsias 14 ciklo dienų patartina vartoti vaistą, kurio sudėtyje yra 2 mg 17-beta-estradiolio, per kitas 14 dienų – 2 mg 17-beta-estradiolio ir 20 mg didrogesterono (10 mg didrogesterono kaip kombinuoto vaisto dalies ir 10 mg didrogesterono atskiroje tabletėje).
Tolesnis paciento gydymas
Nėštumo eigos ypatybės su dvirage gimda arba gimdos padvigubėjimu (kai yra 2 gimdos ertmės):
- ankstyvosiose nėštumo stadijose kraujavimas dažnai pasireiškia iš „tuščio“ rago ar gimdos ertmės dėl ryškios decidualinės reakcijos; taktika šiuo atveju turėtų būti konservatyvi ir apimti antispazminių ir hemostazinių vaistų vartojimą;
- nėštumo nutraukimo grėsmė įvairiais etapais;
- isteminio-gimdos kaklelio nepakankamumo vystymasis;
- Intrauterininis augimo sulėtėjimas dėl placentos nepakankamumo.
Ankstyvosiose nėštumo stadijose, kraujavimo atveju, patartina laikytis lovos ir pusiau lovos režimo, taip pat vartoti hemostatinius, antispazminius ir raminamuosius vaistus bei gydyti gestagenais (didrogesteronu, kurio paros dozė yra 20–40 mg) iki 16–18 nėštumo savaitės.
Endokrininės įprasto persileidimo priežastys
Įvairių autorių teigimu, endokrininės persileidimo priežastys sudaro 8–20 %. Reikšmingiausios iš jų yra liuteininės fazės nepakankamumas (LPD), LH hipersekrecija, skydliaukės disfunkcija ir cukrinis diabetas.
Sunki skydliaukės liga arba cukrinis diabetas gali sukelti pakartotinius persileidimus. Tačiau sergant kompensuojamu cukriniu diabetu, įprastų persileidimų rizika nesiskiria nuo bendros populiacijos rizikos.
Tuo pačiu metu didelis hipotirozės paplitimas populiacijoje reikalauja atrankos, matuojant TSH lygį. Pacientams, sergantiems įprastu persileidimu, liuteininės fazės nepakankamumas stebimas 20–60 % atvejų, o policistinių kiaušidžių ultragarsiniai požymiai – 44–56 %. Literatūros duomenimis, atskirų hormoninių sutrikimų įtaka įprastų persileidimų simptomų komplekso formavimuisi tebėra prieštaringa. M. Ogasawara ir kt. (1997) tyrimai neatskleidė patikimų nėštumo nutraukimo su ir be LPI dažnio skirtumų pacientams, kuriems anamnezėje buvo du ar daugiau persileidimų, išskyrus autoimunines, anatomines ir infekcines priežastis.
Geltonkūnio funkcijos nepakankamumas gali būti daugelio nepalankių veiksnių rezultatas:
- FSH ir LH sekrecijos sutrikimai pirmajame menstruacinio ciklo etape;
- ankstyvas arba, atvirkščiai, per vėlyvas LH išsiskyrimo pikas;
- Hipoestrogenizmas dėl nepakankamo folikulogenezės proceso. Visos šios būklės nėra koreguojamos pakaitine terapija gestageniniais vaistais po ovuliacijos. L. Regan ir kt. atlikti perspektyviniai tyrimai parodė, kad pacientams, kuriems yra LH hipersekrecija 8-ąją menstruacinio ciklo dieną, persileidimų dažnis žymiai padidėjo, palyginti su moterimis, kurių LH kiekis kraujyje normalus (atitinkamai 65% ir 12% persileidimų). Žalingas ne laiku išsiskyrusio LH poveikis susijęs su priešlaikiniu antrojo mejozinio dalijimosi atnaujinimu ir nesubrendusios kiaušialąstės ovuliacija, taip pat su androgenų gamybos indukcija tekos ląstelėse kartu su sutrikusia endometriumo recepcija dėl gestageno nepakankamumo. Tačiau preliminarus preovuliacinio LH kiekio sumažinimas gonadotropiną atpalaiduojančio hormono agonistais be papildomų priemonių, skirtų vėlesniam nėštumui pailginti, nesuteikia laukiamo persileidimų dažnio sumažėjimo.
Auksinis NLF diagnozavimo standartas yra histologinis endometriumo biopsijos medžiagos, gautos antroje ciklo fazėje per 2 menstruacinius ciklus, tyrimas.
Diagnozuojant kitas ovuliacijos disfunkcijos priežastis, tokias kaip hiperprolaktinemija, hipotireozė, funkcinis androgenų (kiaušidžių ar antinksčių) perteklius, būtina skirti tinkamą gydymą.
Diagnostika
Anamnezė ir fizinė apžiūra
- Anamnezė. Įvertintini veiksniai: vėlyvos menstruacijos, nereguliarus menstruacinis ciklas (oligomenorėja, amenorėja, staigus svorio padidėjimas, svorio kritimas, nevaisingumas, įprasti ankstyvi persileidimai).
- Apžiūra: kūno tipas, ūgis, kūno svoris, hirsutizmas, antrinių lytinių požymių sunkumas, strijų buvimas, pieno liaukų apžiūra dėl galaktorėjos.
- Funkciniai diagnostiniai tyrimai: tiesiosios žarnos temperatūros matavimas per 3 menstruacinius ciklus.
Specialūs tyrimo metodai
- Hormonų tyrimas:
- I menstruacinio ciklo fazėje (7–8 dieną) – FSH, LH, prolaktino, TSH, testosterono, 17-hidroksiprogesterono (17-OP), DHEAS kiekio nustatymas;
- II menstruacinio ciklo fazėje (21–22 dienos) – progesterono kiekio nustatymas (norminiai progesterono lygio rodikliai yra labai įvairūs, metodo negalima naudoti neatsižvelgiant į kitus veiksnius).
- Ultragarsas:
- I menstruacinio ciklo fazėje (5–7 dieną) – endometriumo patologijos, policistinių kiaušidžių diagnozė;
- II menstruacinio ciklo fazėje (20–21 dieną) – endometriumo storio matavimas (normaliai 10–11 mm, koreliuoja su progesterono kiekiu).
- Endometriumo biopsija NLF patvirtinimui atliekama 2 dienas prieš numatomas menstruacijas (26 dieną, kai ciklas trunka 28 dienas). Šis metodas naudojamas tais atvejais, kai diagnozė neaiški. Norint ištirti endometriumo pokyčius vadinamuoju „implantacijos lango“ laikotarpiu, biopsija atliekama 6 dieną po ovuliacijos.
Gydymas
Diagnozuojant NLF (pagal tiesiosios žarnos temperatūros grafikus, antrosios fazės trukmė yra mažesnė nei 11 dienų, stebimas laipsniškas temperatūros padidėjimas, nepakankama endometriumo sekrecinė transformacija pagal endometriumo biopsijos duomenis, mažas progesterono kiekis kraujo serume), būtina nustatyti tokių sutrikimų priežastį.
Jei NLF lydi hiperprolaktinemija, atliekamas smegenų MRT tyrimas. Alternatyvus metodas yra kaukolės (turkio kaulo srities) rentgeno tyrimas.
Pirmasis hiperprolaktinemijos etapas – hipofizės adenomos pašalinimas, kuriam gydyti reikalingas chirurginis gydymas. Nesant reikšmingų pokyčių, hiperprolaktinemija laikoma funkcine, o bromokriptino vartojimas skiriamas prolaktino kiekiui normalizuoti. Pradinė bromokriptino dozė yra 1,25 mg/d. 2 savaites, stebint prolaktino kiekį, jei rodikliai nenormalizuojasi, dozė didinama iki 2,5 mg/d. Reikšmingai padidėjus prolaktino kiekiui, pradinė dozė yra 2,5 mg/d. Jei pastojama, bromokriptino vartojimą reikia nutraukti.
Jei nustatoma hipotireozė, kartu su endokrinologu nustatomas skydliaukės patologijos pobūdis. Bet kuriuo atveju, rekomenduojama kasdien vartoti natrio levotiroksiną, kurio dozė parenkama individualiai, kol normalizuojasi TSH lygis. Pastojus, gydymą natrio levotiroksinu reikia tęsti. Klausimas dėl dozės didinimo tikslingumo pirmąjį nėštumo trimestrą sprendžiamas kartu su endokrinologu, gavus hormonų tyrimo rezultatus (TSH lygis, laisvas tiroksinas).
NLF korekcija atliekama vienu iš dviejų būdų. Pirmasis būdas yra ovuliacijos stimuliavimas, antrasis būdas yra pakaitinė terapija progesterono preparatais.
Pirmasis gydymo būdas – ovuliacijos stimuliavimas klomifeno citratu. Šis gydymo metodas pagrįstas tuo, kad dauguma liuteininės fazės sutrikimų atsiranda folikulinėje ciklo fazėje. Nuolat sumažėjęs progesterono kiekis antrojoje fazėje yra sutrikusios folikulogenezės pirmojoje ciklo fazėje pasekmė. Šį sutrikimą sėkmingiau koreguoja mažos klomifeno citrato dozės ankstyvojoje folikulinėje fazėje, nei progesterono skyrimas antrojoje ciklo fazėje.
Pirmojo ciklo metu klomifeno citrato dozė yra 50 mg per parą nuo 5 iki 9 menstruacinio ciklo dienos. Veiksmingumas stebimas matuojant tiesiosios žarnos temperatūrą, progesterono kiekį antroje ciklo fazėje arba dinaminiu ultragarsu. Jei antrojo ovuliacijos stimuliavimo ciklo metu nėra pakankamo poveikio, klomifeno citrato dozę reikia padidinti iki 100 mg per parą nuo 5 iki 9 ciklo dienos. Didžiausia galima dozė trečiojo ovuliacijos stimuliavimo ciklo metu yra 150 mg per parą. Toks dozės didinimas galimas tik tuo atveju, jei vaistas gerai toleruojamas (nėra stipraus skausmo apatinėje pilvo dalyje ir nugaros dalyje bei kitų kiaušidžių hiperstimuliacijos požymių).
Antrasis gydymo variantas: pakaitinė terapija progesterono preparatais, skatinanti visišką endometriumo sekrecinę transformaciją, kuri suteikia reikiamą poveikį pacientėms, sergančioms įprastu persileidimu su išsaugota ovuliacija. Be to, pastaraisiais metais nustatyta, kad progesterono preparatų vartojimas turi ne tik hormoninį, bet ir imunomoduliacinį poveikį, slopindamas imunokompetentinių endometriumo ląstelių atmetimo reakcijas. Panašus poveikis aprašytas ir dihidrogesteronui, vartojamam 20 mg per parą doze. Pakaitinės terapijos tikslais didrogesteronas vartojamas per burną 20 mg per parą doze arba mikronizuotas progesteronas į makštį 200 mg per parą doze. Gydymas atliekamas antrą dieną po ovuliacijos (kitą dieną po tiesiosios žarnos temperatūros padidėjimo) ir tęsiamas 10 dienų. Pastojus, gydymą progesterono preparatais reikia tęsti.
Šiuolaikiniai tyrimai nepatvirtino žmogaus chorioninio gonadotropino veiksmingumo gydant pasikartojantį persileidimą.
Hiperandrogenizmo (kiaušidžių ar antinksčių kilmės) atveju pacientams, kuriems yra įprastas persileidimas, gydymas vaistais yra nurodytas dėl androgenų poveikio ovuliacijos išsamumui ir endometriumo būklei. Sutrikus antinksčių androgenų biosintezei, galimas jų virilizuojamasis poveikis moters vaisiui, todėl steroidų terapija atliekama vaisiaus labui.
Kiaušidžių genezės hiperandrogenizmas (policistinės kiaušidės)
Anamnezė, fizinė apžiūra ir specialiųjų tyrimų rezultatai
- Anamnezė: vėlyvos menarchės, menstruacinio ciklo sutrikimai, tokie kaip oligomenorėja (dažniausiai pirminė, rečiau antrinė). Nėštumas retas, dažniausiai savaime nutrūksta pirmąjį trimestrą, tarp nėštumų būna ilgi nevaisingumo laikotarpiai.
- Apžiūra: hirsutizmas, spuogai, strijos, didelis kūno masės indeksas (nebūtina).
- Tiesiosios žarnos temperatūros diagramos: anovuliaciniai ciklai kaitaliojasi su ciklais su ovuliacija ir NLF.
- Hormonų tyrimas: aukštas testosterono kiekis, FSH ir LH kiekis gali būti padidėjęs, LH/FSH santykis didesnis nei 3. Ultragarsas: policistinės kiaušidės.
Gydymas
Nemedikamentinis gydymas
Svorio metimas – dietos terapija, fizinis aktyvumas.
Narkotikų gydymas
- Orlistatas, vartojamas po 120 mg kiekvieno pagrindinio valgio metu. Kurso trukmė nustatoma atsižvelgiant į poveikį ir toleravimą.
- Preliminarus testosterono kiekio mažinimas preparatais, kurių sudėtyje yra ciproterono acetato (2 mg) ir EE (35 mcg), 3 menstruacinius ciklus.
- Kontracepcijos nutraukimas, antrosios ciklo fazės hormoninė parama (gestageninė terapija) – didrogesteronas 20 mg/d. doze nuo 16 iki 25 menstruacinio ciklo dienos. Jei savaiminės ovuliacijos nėra, pereikite prie kito etapo.
- Ovuliacijos stimuliavimas klomifeno citratu, pradinė 50 mg/d. dozė nuo 5 iki 9 menstruacinio ciklo dienos, kartu vartojant gestagenus (didrogesteroną 20 mg/d. dozė nuo 16 iki 25 ciklo dienos) ir deksametazoną (0,5 mg).
- Nesant nėštumo, klomifeno citrato dozė didinama iki 100–150 mg/d., antroje ciklo fazėje skiriant gestagenų ir deksametazono (0,5 mg). Nustatyta, kad nors deksametazonas sumažina tik antinksčių androgenų kiekį, ovuliacija ir pastojimas gydant klomifeno citratu ir deksametazonu įvyksta žymiai dažniau nei vartojant tik klomifeno citratą [12].
- Atliekami trys ovuliacijos stimuliacijos ciklai, po kurių rekomenduojama padaryti trijų menstruacinių ciklų pertrauką su gestagenine parama ir nuspręsti dėl chirurginio gydymo naudojant laparoskopinę prieigą (kiaušidžių pleišto rezekcija, lazerinis garinimas).
Tolesnis paciento gydymas
Nėštumo valdymas turėtų būti derinamas su gestageniniu palaikymu iki 16 nėštumo savaitės (didrogesteronas 20 mg/d. dozėje arba mikronizuotas progesteronas 200 mg/d. dozėje), deksametazonas skiriamas tik pirmąjį nėštumo trimestrą. Stebėjimas yra būtinas, kad būtų galima laiku diagnozuoti gimdos kaklelio nepakankamumą ir, jei reikia, jį chirurgiškai ištaisyti.
Antinksčių hiperandrogenizmas (brendimo ir postpubertalinis adrenogenitalinis sindromas)
Adrenogenitalinis sindromas (AGS) yra paveldima liga, susijusi su antinksčių žievės hormonų sintezės sutrikimu dėl genų, atsakingų už daugelio fermentų sistemų sintezę, pažeidimo. Liga paveldima autosominiu recesyviniu būdu, perduodant mutantinius genus iš abiejų tėvų, kurie yra sveiki nešiotojai.
90% atvejų adrenogenitalinį sindromą sukelia CYP21B geno mutacijos, dėl kurių sutrinka 21-hidroksilazės sintezė.
Anamnezė, fizinė apžiūra ir specialiųjų tyrimų rezultatai
- Anamnezė: vėlyvos menstruacijos, šiek tiek pailgėjęs menstruacinis ciklas, galima oligomenorėja, savaiminiai persileidimai pirmąjį trimestrą, galimas nevaisingumas.
- Apžiūra: spuogai, hirsutizmas, androidinis kūno tipas (platūs pečiai, siauras dubuo), klitorio hipertrofija.
- Tiesiosios žarnos temperatūros diagramos: anovuliaciniai ciklai kaitaliojasi su ciklais su ovuliacija ir NLF.
- Hormoninis testas: didelis 17-OP, DHEAS lygis.
- Ultragarsas: kiaušidės nepakitusios.
Patognominis požymis ne nėštumo metu yra 17-OP koncentracijos padidėjimas kraujo plazmoje.
Šiuo metu latentinei, neklasikinei antinksčių hiperandrogenizmo formai diagnozuoti naudojamas testas su AKTH. Šiam tyrimui naudojamas Synacthen – sintetinis polipeptidas, turintis endogeninio AKTH savybių, t. y. stimuliuoja pradines steroidinių hormonų sintezės iš cholesterolio fazes antinksčiuose.
Synacthen testas (AKTH analogas): 1 ml (0,5 mg) synacthen suleidžiama po oda į petį, pradinis 17-OP ir kortizolio kiekis pirmiausia nustatomas rytiniame 9 valandų kraujo plazmos mėginyje. Kontrolinis kraujo mėginys imamas praėjus 9 valandoms po injekcijos, siekiant nustatyti 17-OP ir kortizolio kiekį. Tada nustatymo indeksas (D) apskaičiuojamas pagal formulę:
D = 0,052 × 17-OP + 0,005 × kortizolis / 17-OP - 0,018 × kortizolis / 17-OP
Jei D koeficientas yra mažesnis arba lygus 0,069, tai rodo, kad antinksčių hiperandrogenizmo nėra. Jei D koeficientas yra didesnis nei 0,069, reikėtų manyti, kad hiperandrogenizmą sukelia antinksčių disfunkcija.
Narkotikų gydymas
Pagrindinis hiperandrogenizmo, kurį sukelia 21-hidroksilazės trūkumas, gydymo būdas yra gliukokortikoidai, kurie naudojami slopinti perteklinę androgenų sekreciją.
Tolesnis paciento gydymas
Dėl virilizuojančio motinos androgenų poveikio vaisiui, diagnozavus antinksčių hiperandrogenizmą, prieš nėštumą skiriama pradinė 0,25 mg deksametazono dozė, kuri tęsiama individualiai parinkta doze (nuo 0,5 iki 1 mg) viso nėštumo metu. Moteriai, kuriai pasireiškia įprastas persileidimas ir kuri kenčia nuo antinksčių hiperandrogenizmo, gydymo nutraukti netikslinga, nes persileidimų dažnis be gydymo siekia 14 %, o tęsiant gydymą – 9 %.
Atsižvelgiant į tai, kad pacientės, sergančios adrenogenitaliniu sindromu, gali perduoti šį geną vaisiui, būtina atlikti prenatalinę diagnostiką: 17–18 nėštumo savaitę atliekamas kraujo tyrimas, siekiant nustatyti 17-OP kiekį motinos organizme. Jei hormono kiekis kraujyje padidėja, nustatoma jo koncentracija vaisiaus vandenyse. Jei 17-OP kiekis vaisiaus vandenyse padidėja, diagnozuojamas vaisiaus adrenogenitalinis sindromas. Deja, adrenogenitalinio sindromo sunkumo (lengva ar druskų eikvojimo sunki forma) nustatyti pagal 17-OP kiekį vaisiaus vandenyse neįmanoma. Nėštumo išsaugojimo klausimą šioje situacijoje sprendžia tėvai.
Jei vaiko tėvas yra adrenogenitalinio sindromo geno nešiotojas ir šeimoje yra buvę atvejų, kai vaikai gimė su šiuo sindromu, tai pacientui, net ir nesant antinksčių hiperandrogenizmo, vaisiaus labui (siekiant išvengti moteriškos lyties vaisiaus virilizacijos) skiriamas deksametazonas 20 mcg/kg kūno svorio doze, ne daugiau kaip 1,5 mg/d., padalijus į 2–3 dozes po valgio. 17–18 savaitę, nustačius vaisiaus lytį ir adrenogenitalinio sindromo geno raišką (remiantis amniocentezės rezultatais), gydymas tęsiamas iki nėštumo pabaigos, jei vaisius yra mergaitė, turinti adrenogenitalinį sindromą. Jei vaisius yra berniukas arba mergaitė, kuri nėra adrenogenitalinio sindromo geno nešiotoja, deksametazono vartojimą galima nutraukti.
Jei moteris, turinti įprastinį persileidimą, kenčia nuo antinksčių hiperandrogenizmo, deksametazono terapija atliekama viso nėštumo metu ir nutraukiama tik po gimdymo. Trečią dieną po gimdymo deksametazono dozė palaipsniui mažinama (po 0,125 mg kas 3 dienas), kol ji visiškai nutraukiama pogimdyminiu laikotarpiu.
Mišrios genezės (kiaušidžių ir antinksčių) hiperandrogenizmas
Anamnezė, fizinė apžiūra ir specialiųjų tyrimų rezultatai
- Anamnezė: vėlyvos menarchės, menstruacinio ciklo sutrikimai, tokie kaip oligomenorėja (dažniausiai pirminė, rečiau antrinė), amenorėja, galimos traumos, smegenų sutrenkimai. Nėštumas retas, dažniausiai savaime nutrūksta pirmąjį trimestrą, ilgi nevaisingumo laikotarpiai tarp nėštumų.
- Fizinis tyrimas: hirsutizmas, spuogai, strijos, juodoji akantozė, didelis kūno masės indeksas, hipertenzija.
- Tiesiosios žarnos temperatūros diagramos: anovuliaciniai ciklai kaitaliojasi su ciklais su ovuliacija ir NLF.
- Hormonų tyrimas: aukštas testosterono kiekis, gali būti padidėjęs FSH ir LH kiekis, LH/FSH santykis didesnis nei 3, didelis DHEAS, 17-OP kiekis, gali būti hiperprolaktinemija.
- Ultragarsas: policistinės kiaušidės.
- Elektroencefalografija: smegenų bioelektrinio aktyvumo pokyčiai.
- Hiperinsulinemija, lipidų apykaitos sutrikimas (padidėjęs cholesterolio kiekis, mažo tankio lipoproteinai ir labai mažo tankio lipoproteinai), sumažėjęs gliukozės tolerancija arba padidėjęs gliukozės kiekis kraujyje.
Gydymas
Nemedikamentinis gydymas
Svorio metimas (mažai kalorijų turinti dieta, fizinis aktyvumas).
Narkotikų gydymas
Pirmasis etapas – esant atsparumui insulinui, rekomenduojama skirti metforminą 1000–1500 mg per parą, kad padidėtų jautrumas insulinui.
Antrasis etapas – esant sunkiems menstruacinio ciklo sutrikimams ir dideliam testosterono kiekiui, rekomenduojama 3 mėnesius skirti antiandrogeninį poveikį turinčių vaistų, kurių sudėtyje yra ciproterono acetato (2 mg) ir etinilestradiolio (35 mcg).
Trečiasis etapas yra ovuliacijos stimuliavimas, po kurio seka gestageninė parama (schema aprašyta aukščiau) ir deksametazono vartojimas 0,25–0,5 mg paros doze.
Hiperprolaktinemijos ir hipotirozės atveju ovuliacijos stimuliavimo ciklų metu reikia atlikti atitinkamą vaistų korekciją. Jei pastojama, bromokriptino vartojimą reikia nutraukti ir tęsti levotiroksino vartojimą.
Jei ovuliacijos stimuliavimas neveiksmingas, reikėtų spręsti dėl tiesioginių ovuliacijos induktorių skyrimo, policistinių kiaušidžių chirurginio gydymo ar apvaisinimo in vitro tikslingumo.
Tolesnis paciento gydymas
Pacientams, sergantiems metaboliniu sindromu, nėštumą dažnai apsunkina arterinė hipertenzija, nefropatija, hiperkoaguliacija, dėl kurios būtina nuo ankstyvųjų nėštumo stadijų stebėti kraujospūdį, hemostaziogramas ir prireikus koreguoti atsiradusius sutrikimus antihipertenziniais vaistais, antitrombocitiniais vaistais ir antikoaguliantais. Iki 16 nėštumo savaičių skiriami gestageniniai vaistai – didrogesteronas 20 mg per parą arba mikronizuotas progesteronas 200 mg per parą, padalytas į 2 dozes.
Visos moterys, sergančios hiperandrogenizmu, yra tarpslankstelinio-gimdos kaklelio nepakankamumo rizikos grupėje. Gimdos kaklelio būklės stebėjimas turėtų būti atliekamas nuo 16-osios nėštumo savaitės, o prireikus – chirurginė tarpslankstelinio-gimdos kaklelio nepakankamumo korekcija.
Imunologinės įprastinio persileidimo priežastys
Šiuo metu žinoma, kad apie 80 % visų anksčiau nepaaiškinamų pakartotinio persileidimo atvejų (atmetus genetines, anatomines, hormonines priežastis) yra susiję su imuniniais sutrikimais. Skiriami autoimuniniai ir aloimuniniai sutrikimai, sukeliantys įprastinį persileidimą.
Autoimuninių procesų metu imuninės sistemos audiniai tampa agresijos objektu, t. y. imuninis atsakas nukreiptas prieš savo antigenus. Tokioje situacijoje vaisius kenčia antriniu būdu dėl motinos audinių pažeidimo.
Aloimuninių sutrikimų atveju moters imuninis atsakas yra nukreiptas prieš embrioninius/vaisiaus antigenus, gautus iš tėvo ir kurie gali būti svetimi motinos organizmui.
Autoimuniniai sutrikimai, dažniausiai pasitaikantys pacientams, sergantiems įprastu persileidimu, yra antifosfolipidinių, antitiroidinių ir antinuklearinių autoantikūnų buvimas serume. Taigi nustatyta, kad 31 % moterų, patyrusių įprastą persileidimą ne nėštumo metu, turi autoantikūnų prieš tireoglobuliną ir skydliaukės peroksidazę (skydliaukės mikrosominiai [skydliaukės peroksidazės] autoantikūnai); šiais atvejais savaiminio persileidimo rizika pirmąjį nėštumo trimestrą padidėja iki 20 %. Įprasto persileidimo atveju antinuklearinių ir antitiroidinių antikūnų buvimas rodo, kad reikia atlikti tolesnius tyrimus, siekiant nustatyti autoimuninį procesą ir patvirtinti diagnozę.
Antifosfolipidinis sindromas (APS) išlieka visuotinai pripažinta autoimuninė būklė, sukelianti embriono / vaisiaus mirtį.
Aloimuniniai sutrikimai
Šiuo metu aloimuniniai procesai, sukeliantys vaisiaus atmetimą, apima padidėjusį (daugiau nei 3) bendrų pagrindinio histosuderinamumo komplekso sistemos antigenų skaičių sutuoktinių organizme (dažnai stebimas kraujomaišos santuokose); žemą blokuojančių faktorių kiekį motinos serume; padidėjusį natūralių žudikų ląstelių (NK ląstelių CD56, CD16) kiekį motinos endometriume ir periferiniame kraujyje tiek nėštumo metu, tiek už jo ribų; didelę daugelio citokinų, ypač γ-interferono, naviko nekrozės faktoriaus a, interleukinų-1 ir 2, koncentraciją endometriume ir kraujo serume.
Šiuo metu tiriami aloimuniniai veiksniai, lemiantys ankstyvą persileidimą, ir būdai, kaip ištaisyti minėtas būkles. Nėra sutarimo dėl gydymo metodų. Kai kurių tyrėjų teigimu, aktyvi imunizacija donorų limfocitais nesukelia reikšmingo poveikio, o kiti autoriai aprašo reikšmingą teigiamą tokios imunizacijos ir gydymo imunoglobulinais poveikį.
Šiuo metu vienas iš imunomoduliacinių vaistų ankstyvuoju nėštumo laikotarpiu yra progesteronas. Visų pirma, tyrimai įrodė didrogesterono, vartojamo 20 mg paros doze, vaidmenį moterims, kurioms pirmąjį nėštumo trimestrą pasireiškė įprastas persileidimas, kai endometriume padidėjo CD56 ląstelių kiekis.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Genetiškai nulemtos trombofilijos
Šios genetiškai nulemtos trombofilijos formos laikomos trombofilinėmis būklėmis nėštumo metu, dėl kurių įvyksta įprastas persileidimas.
- Antitrombino III trūkumas.
- V faktoriaus mutacija (Leideno mutacija).
- Baltymo C trūkumas.
- Baltymų S trūkumas.
- Protrombino geno mutacija G20210A.
- Hiperhomocisteinemija.
Retų trombofilijos priežasčių nustatymo tyrimas būtinas tais atvejais, kai buvo:
- šeimos istorija - tromboembolija iki 40 metų amžiaus giminaičiuose;
- patikimi venų ir (arba) arterijų trombozės epizodai iki 40 metų amžiaus;
- pasikartojanti trombozė pacientui ir artimiausiems giminaičiams;
- Tromboembolinės komplikacijos nėštumo metu ir po gimdymo, vartojant hormoninius kontraceptikus;
- pakartotiniai persileidimai, negyvagimiai, intrauterininis augimo sulėtėjimas, placentos atitrūkimas;
- ankstyva preeklampsija, HELLP sindromas.
Infekcinės įprastinio persileidimo priežastys
Šiuo metu plačiai diskutuojama apie infekcinio veiksnio, kaip įprastinio persileidimo priežasties, vaidmenį. Yra žinoma, kad pirminė infekcija ankstyvosiose nėštumo stadijose gali sukelti embrionui su gyvybe nesuderinamą žalą, dėl kurios įvyksta sporadiškas savaiminis persileidimas. Tačiau infekcijos reaktyvacijos tikimybė tuo pačiu metu ir pakartotinių persileidimų pasekmėmis yra nereikšminga. Be to, šiuo metu nerasta mikroorganizmų, kurie išprovokuotų įprastinį persileidimą. Pastarųjų metų tyrimai parodė, kad daugumai moterų, sergančių įprastiniu persileidimu ir lėtiniu endometritu, endometriume yra 2–3 ar daugiau tipų obligatinių anaerobinių mikroorganizmų ir virusų.
Pasak V. M. Sidelnikovos ir kt., moterims, kenčiančioms nuo įprastinio persileidimo, lėtinio endometrito diagnozė ne nėštumo metu buvo histologiškai patvirtinta 73,1 % atvejų, o 86,7 % atvejų buvo pastebėtas oportunistinių mikroorganizmų išlikimas endometriume, kuris neabejotinai gali būti imunopatologinių procesų aktyvacijos priežastis. Mišri persistuojanti virusinė infekcija (herpes simplex virusas, Coxsackie A, Coxsackie B, enterovirusai 68–71, citomegalovirusas) pacientams, sergantiems įprastiniu persileidimu, nustatoma žymiai dažniau nei moterims, turinčioms normalią akušerinę anamnezę. K. Kohut ir kt. (1997) parodė, kad uždegiminių pokyčių endometriume ir decidualiniame audinyje procentas pacientams, sergantiems pirminiu pasikartojančiu persileidimu, yra žymiai didesnis nei moterims po persileidimo, kurioms buvo bent vienas pilnas gimdymas.
Bakterinė ir virusinė endometriumo kolonizacija dažniausiai atsiranda dėl imuninės sistemos ir nespecifinių organizmo apsauginių jėgų (komplemento sistemos, fagocitozės) nesugebėjimo visiškai pašalinti infekcinio agento, o tuo pačiu metu jo plitimą riboja T limfocitų (T pagalbininkų, natūralių žudikų) ir makrofagų aktyvacija. Visais minėtais atvejais pasireiškia mikroorganizmų persistencija, kuriai būdingas mononuklearinių fagocitų, natūralių žudikų, T pagalbininkų, sintetinančių įvairius citokinus, pritraukimas į lėtinio uždegimo vietą. Matyt, tokia endometriumo būsena neleidžia susidaryti vietinei imunosupresijai preimplantaciniu laikotarpiu, kuri yra būtina apsauginiam barjerui susidaryti ir išvengti pusiau svetimo vaisiaus atmetimo.
Šiuo atžvilgiu, prieš nėštumą moterims, kurioms yra įprastas persileidimas, turėtų būti diagnozuotas lėtinis endometritas. Norint nustatyti arba atmesti šią diagnozę, 7–8 menstruacinio ciklo dieną atliekama endometriumo biopsija, atliekant histologinį, PGR ir bakteriologinį gimdos ertmės medžiagos tyrimą. Patvirtinant diagnozę, lėtinis endometritas gydomas pagal dubens organų uždegiminių ligų gydymo standartus.

