Medicinos ekspertas
Naujos publikacijos
Žmogaus imunodeficito virusas (ŽIV)
Paskutinį kartą peržiūrėta: 04.07.2025

Visas „iLive“ turinys yra peržiūrėtas medicinoje arba tikrinamas, kad būtų užtikrintas kuo didesnis faktinis tikslumas.
Mes turime griežtas įsigijimo gaires ir susiejamos tik su geros reputacijos žiniasklaidos svetainėmis, akademinių tyrimų institucijomis ir, jei įmanoma, medicininiu požiūriu peržiūrimais tyrimais. Atkreipkite dėmesį, kad skliausteliuose ([1], [2] ir tt) esantys numeriai yra paspaudžiami nuorodos į šias studijas.
Jei manote, kad bet koks mūsų turinys yra netikslus, pasenęs arba kitaip abejotinas, pasirinkite jį ir paspauskite Ctrl + Enter.
Įgytas imunodeficito sindromas kaip specifinė liga buvo identifikuotas 1981 m. Jungtinėse Valstijose, kai nemažai jaunų žmonių susirgo sunkiomis ligomis, kurias sukėlė mikroorganizmai, kurie sveikiems žmonėms nebuvo patogeniški arba buvo silpnai patogeniški. Pacientų imuninės būklės tyrimas atskleidė staigų limfocitų skaičiaus sumažėjimą apskritai ir ypač T pagalbininkų skaičių. Ši būklė buvo pavadinta AIDS (įgytu imunodeficito sindromu). Užsikrėtimo būdas (lytinis kontaktas, per kraują ir jo preparatus) rodė infekcinį ligos pobūdį.
AIDS sukėlėją 1983 m. savarankiškai atrado prancūzas L. Montagnier, pavadinęs jį LAV limfoadenopatijos asocijuotu virusu, nes jį aptiko limfadenopatija sergančio paciento organizme; ir amerikietis R. Gallo, pavadinęs virusą HTLV-III (žmogaus T limfotropiniu virusu III): anksčiau jis buvo atradęs limfotropinius virusus I ir II.
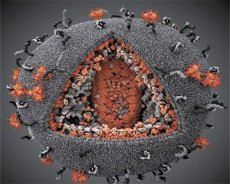
Palyginus LAV ir HTLV-III virusų savybes, paaiškėjo jų tapatumas, todėl siekiant išvengti painiavos, 1986 m. virusas buvo pavadintas ŽIV (žmogaus imunodeficito virusu arba ŽIV). ŽIV yra sferinės formos, jo skersmuo – 110 nm. Viruso apvalkalas yra daugiakampio formos, sudarytas iš 12 penkiakampių ir 20 šešiakampių. Kiekvieno šešiakampio centre ir kampuose yra glikozilinto baltymo gpl20 molekulė (skaičius 120 rodo baltymo molekulinę masę kilodaltonais). Iš viso viriono paviršiuje yra 72 gpl20 molekulės, išsidėsčiusios savotiškų smaigalių pavidalu, kurių kiekviena yra susijusi su intramembraniniu baltymu gp41. Šie baltymai kartu su dvigubu lipidų sluoksniu sudaro viriono superkapsidę (membraną).
Gpl20 ir gp41 baltymai susidaro ląstelinės proteazės perkerpant Env pirmtako baltymą. gp41 baltymas sudaro smaigalio „stiebą“, savo citoplazminiu domenu prisijungdamas prie matricos baltymo p17MA, esančio tiesiai po apvalkalu. p17 molekulės sąveikauja viriono brendimo metu ir sudaro ikosaedrą po apvalkalu.
Centrinėje viriono dalyje p24 baltymas sudaro kūgio formos kapsidę. Susiaurėjusi kapsidės dalis yra sujungta su viriono membrana, dalyvaujant rb baltymui. Kapsidės viduje yra dvi identiškos virusinės genominės RNR molekulės. 5' galais jos sujungtos su nukleokapsidės baltymu p7NC. Šis baltymas įdomus tuo, kad turi dvi aminorūgščių liekanas (motyvus), kuriose gausu cisteino ir histidino bei yra Zn atomas – jos vadinamos „cinko pirštais“, nes jos pagauna genominės RNR molekules, kad jas įtrauktų į besiformuojančius virionus. Kapsidėje taip pat yra trys fermentai. Revertazė (RT), arba pol kompleksas, apima atvirkštinę transkriptazę, RNazę H ir nuo DNR priklausomą DNR polimerazę. Revertazė yra heterodimero p66/p51 pavidalu. Proteazė (PR) – p10 – inicijuoja ir įgyvendina viriono brendimo procesą. Integrazė (IN) – p31 – arba endonukleazė – užtikrina provirusinės DNR įtraukimą į šeimininko ląstelės genomą. Kapsidėje taip pat yra pradinės RNR molekulė (tRNR1"3).
Ląstelėje esantis RNR genomas atvirkštinės transkriptazės pagalba paverčiamas DNR genomu (DNR provirusu), kurį sudaro 9283 nukleotidų poros. Kairėje ir dešinėje jį riboja vadinamieji ilgi terminaliniai pasikartojimai arba LTR: kairėje S'-LTR ir dešinėje 3'-LTR. Kiekviename LTR yra po 638 nukleotidų poras.
ŽIV genomą sudaro 9 genai, kai kurie iš jų persidengia galuose (turi kelis skaitymo rėmelius) ir turi egzonintroninę struktūrą. Jie kontroliuoja 9 struktūrinių ir 6 reguliacinių baltymų sintezę.
LTR svarba viruso genomui yra ta, kad juose yra šie reguliavimo elementai, kurie kontroliuoja jo veikimą:
- transkripcijos signalas (promotoriaus regionas);
- poli-A pridėjimo signalas;
- ribojimo signalas;
- integracijos signalas;
- teigiamas reguliavimo signalas (TAR TAT baltymui);
- neigiamas reguliavimo elementas (NRE NEF baltymui);
- 3' gale esanti vieta, kur prisitvirtina pradinė RNR (tRNR™3), skirta minusinės grandinės DNR sintezei; signalas LTR 5' gale, kuris tarnauja kaip pradmuo pliusinės grandinės DNR sintezei.
Be to, LTR yra elementų, dalyvaujančių mRNR splaisingo reguliavime, vRNR molekulių pakavime į kapsidę (Psi elementas). Galiausiai, genomo transkripcijos metu ilgose mRNR susidaro du signalai REV baltymui, kurie perjungia baltymų sintezę: CAR – reguliuojantiems baltymams ir CRS – struktūriniams baltymams. Jei REV baltymas prisijungia prie CAR, sintetinami struktūriniai baltymai; jei jo nėra, sintetinami tik reguliuojantys baltymai.
Šie reguliuojantys genai ir jų baltymai atlieka ypač svarbų vaidmenį reguliuojant viruso genomo funkcionavimą:
- TAT baltymas, kuris atlieka teigiamą viruso replikacijos kontrolę ir veikia per TAR reguliavimo regioną;
- NEV ir VPU baltymai, kurie neigiamai kontroliuoja replikaciją per NRE regioną;
- REV baltymas, kuris atlieka teigiamą-neigiamą kontrolę. REV baltymas kontroliuoja gag, pol, env genų darbą ir atlieka neigiamą splaisingo reguliavimą.
Taigi, ŽIV replikacija yra trigubai kontroliuojama – teigiama, neigiama ir teigiamai neigiama.
VIF baltymas lemia naujai susintetinto viruso užkrečiamumą. Jis susijęs su p24 kapsidės baltymu ir virione yra 60 molekulių. NEF baltymą virione reprezentuoja nedidelis molekulių skaičius (5–10), galbūt susijęs su apvalkalu.
VPR baltymas slopina ląstelės ciklą G2 fazėje, dalyvauja preintegracijos kompleksų pernašoje į ląstelės branduolį, aktyvuoja kai kuriuos virusinius ir ląstelinius genus bei padidina viruso replikacijos efektyvumą monocituose ir makrofaguose. VPR, TAT, REV ir VPU baltymų vieta virione nenustatyta.
Be savų baltymų, viriono membranoje gali būti ir šeimininkės ląstelės baltymų. VPU ir VPR baltymai dalyvauja reguliuojant viruso dauginimąsi.
Žmogaus imunodeficito viruso (ŽIV) antigeniniai variantai
Žmogaus imunodeficito virusas (ŽIV) yra labai kintamas. Net iš vieno paciento organizmo galima išskirti viruso padermes, kurios labai skiriasi antigeninėmis savybėmis. Tokį kintamumą skatina intensyvus CD4+ ląstelių naikinimas ir galingas antikūnų atsakas į ŽIV infekciją. Iš Vakarų Afrikos pacientų buvo išskirta nauja ŽIV forma – ŽIV-2, biologiškai artima ŽIV-1, bet imunologiškai kitokia. Šių virusų genomų pirminės struktūros homologija yra 42 %. DNR provirusas ŽIV-2 turi 9671 bp, o jo LTR – 854 bp. Vėliau ŽIV-2 buvo išskirtas kituose pasaulio regionuose. Tarp ŽIV-1 ir ŽIV-2 nėra kryžminio imuniteto. Žinomos dvi didelės ŽIV-1 formos: O (išskirtinė) ir M (pagrindinė), pastarasis skirstomas į 10 potipių (AJ). Rusijoje cirkuliuoja aštuoni potipiai (AH).
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
ŽIV sąveikos su ląstele mechanizmas
Patekęs į organizmą, virusas pirmiausia atakuoja ląsteles, turinčias jam būdingą CD4 receptorių. Didelis šio receptoriaus kiekis yra T helperiuose, mažesnis – makrofaguose ir monocituose, o T helperiai yra ypač jautrūs virusui.
Žmogaus imunodeficito virusas (ŽIV) atpažįsta CD4 receptorius naudodamas savo gpl20 baltymą. ŽIV sąveikos su ląstele procesas vyksta pagal šią schemą: receptorių tarpininkaujanti adsorbcija -> dengta duobė -> dengta pūslelė -> lizosoma. Joje viriono membrana susilieja su lizosomos membrana, o nukleokapsidė, atsiskyrusi nuo superkapsidės, patenka į citoplazmą; pakeliui į branduolį ji sunaikinama, o genominė RNR ir susiję pagrindiniai komponentai išsiskiria. Tada atvirkštinė transkriptazė sintetina minusinę DNR grandinę ant viriono RNR, tada RNazė H sunaikina viriono RNR, o virusinė DNR polimerazė sintetina pliusinę DNR grandinę. DNR proviruso galuose susidaro 5'-LTR ir 3'-LTR. DNR provirusas kurį laiką gali išlikti branduolyje neaktyvioje formoje, tačiau anksčiau ar vėliau, padedamas savo integrazės, jis integruojasi į tikslinės ląstelės chromosomą. Jame provirusas išlieka neaktyvus tol, kol atitinkamą T limfocitą aktyvuoja mikrobiniai antigenai arba kitos imunokompetentės ląstelės. Ląstelės DNR transkripcijos aktyvavimą reguliuoja specialus branduolinis faktorius (NF-kB). Tai DNR prisijungiantis baltymas, kuris dideliais kiekiais gaminamas aktyvuojant ir proliferuojant T limfocitams ir monocitams. Šis baltymas jungiasi prie tam tikrų ląstelės DNR sekų ir panašių DNR proviruso LTR sekų ir indukuoja tiek ląstelės DNR, tiek DNR proviruso transkripciją. Indukuodamas DNR proviruso transkripciją, jis atlieka viruso perėjimą iš neaktyvios būsenos į aktyvią ir atitinkamai iš nuolatinės infekcijos į produktyvią. Provirusas gali išlikti neaktyvioje būsenoje labai ilgą laiką. Viruso aktyvavimas yra kritinis momentas jo sąveikoje su ląstele.
Nuo to momento, kai virusas prasiskverbia į ląstelę, prasideda ŽIV infekcijos laikotarpis – viruso nešiotojo būsena, kuri gali trukti 10 metų ar ilgiau; o nuo viruso aktyvavimo momento prasideda liga – AIDS. Padedamas savo reguliacinių genų ir jų produktų, virusas pradeda aktyviai daugintis. TAT baltymas gali padidinti viruso dauginimosi greitį 1000 kartų. Virusų transkripcija yra sudėtinga. Ji apima tiek pilno ilgio, tiek subgenominės mRNR susidarymą, mRNR splaisingą, o tada vyksta struktūrinių ir reguliacinių baltymų sintezė.
Struktūrinių baltymų sintezė vyksta taip. Pirmiausia sintetinamas Pr55Gag pirmtakinis poliproteinas (baltymas, kurio molekulinė masė yra 55 kDa). Jį sudaro 4 pagrindiniai domenai: matrica (MA), kapsidė (CA), nukleokapsidė (NC) ir rb domenas, iš kurių, virusinei proteazei perkerpant Pr55Gag (jis pats perkerpamas nuo kito pirmtako baltymo – Gag-Pol), susidaro atitinkamai struktūriniai baltymai p17, p24, p7 ir rb. Pr55Gag poliproteino susidarymas yra pagrindinė virusinių dalelių susidarymo sąlyga. Būtent šis baltymas lemia viriono morfogenezės programą. Ji nuosekliai apima Gag poliproteino transportavimo į plazminę membraną, sąveikos su ja ir baltymų sąveikos etapus virusinės dalelės formavimosi ir jos pumpuravimo metu. Pr55Gag sintetinamas laisvose poliribosomose; baltymų molekulės transportuojamos į membraną, kur jos yra įtvirtinamos savo hidrofobinėmis sritimis. CA domenas atlieka pagrindinį vaidmenį kuriant natūralią Gag baltymo konformaciją. NC domenas užtikrina, kad (savo „cinko pirštų“ pagalba) į besiformuojančios virusinės dalelės sudėtį būtų įtrauktos dvi genominės RNR molekulės. Dėl matricos domenų sąveikos poliproteino molekulė iš pradžių dimerizuojasi. Vėliau, dėl CA ir NC domenų sąveikos, dimerai susijungia į heksamerinius (6 vienetų) kompleksus. Galiausiai, heksamerai, susijungę šoniniais paviršiais, sudaro nesubrendusius sferinius virionus, kurių viduje yra genominė virusinė RNR, užfiksuota NC domeno.
Kitas pirmtakinis baltymas Prl60Gag-Pol (baltymas, kurio molekulinė masė yra 160 kDa), yra sintetinamas ribosomai poslinkant rėmelį transliuojant gag geno 3' galą srityje, esančioje tiesiai prieš rb baltymą koduojantį sritį. Šis Gag-Pol poliproteinas turi nepilną Gag baltymo seką (1–423 aminorūgštys) ir Pol sekas, apimančias PR, RT ir IN domenus. Gag-Pol poliproteino molekulės taip pat sintetinamos laisvose poliribosomose ir yra transportuojamos į plazminę membraną. Prl60Gagpol poliproteinas turi visas tarpmolekulinės sąveikos vietas ir membranos prisijungimo vietas, būdingas Gag poliproteinui. Todėl Gag-Pol poliproteino molekulės susilieja su membrana ir kartu su Gag molekulėmis yra įtraukiamos į formuojančius virionus, todėl atsiranda aktyvi proteazė ir prasideda viriono brendimo procesas. ŽIV-1 proteazė yra labai aktyvi tik dimero pavidalu, todėl norint savarankiškai išsiskirti iš Prl60Gag-Pol, reikalinga šių molekulių dimerizacija. Viriono brendimas susideda iš to, kad išsiskyrusi aktyvi proteazė perpjauna prl60Gag-Pol ir Gag55 jų atpažįstamose vietose; susidaro baltymai p17, p24, p7, p6, revertazė, integrazė ir vyksta jų prisijungimas prie viruso struktūros.
Env baltymas sintetinamas ribosomose, susijusiose su endoplazminio tinklo membranomis, po to glikozilinamas, ląstelės proteazė jį suskaido į gp120 ir gp41 ir perneša į ląstelės paviršių. Šiuo atveju gp41 prasiskverbia pro membraną ir prisijungia prie Gag baltymo molekulės matricos domenų, susijusių su vidiniu membranos paviršiumi. Šis ryšys išlieka ir subrendusiame virione.
Taigi, virusinių dalelių surinkimas susideda iš prekursorių baltymų ir susijusių RNR molekulių agregacijos šeimininkės ląstelės plazminėje membranoje, nesubrendusių virionų susidarymo ir jų išskyrimo pumpuruojant iš ląstelės paviršiaus. Pumpuravimo metu virionas apsupa save ląstelės membrana, į kurią įterpiamos gp41 ir gp120 molekulės. Pumpuravimo metu arba, galbūt, po virionų išskyrimo, vyksta jų brendimas, kuris atliekamas padedant virusinei proteazei ir susideda iš proteolitinio prekursorių baltymų Pr55Gag ir Prl60Gag-Pol pjaustymo į subrendusio viruso baltymus ir jų sujungimo į tam tikrus struktūrinius kompleksus. Pagrindinį vaidmenį viruso morfogenezės procesuose atlieka prekursorius poliproteinas Pr55Gag, kuris organizuoja ir surenka nesubrendusį virioną; jo brendimo procesą užbaigia specifinė virusinė proteazė.
Imunodeficito priežastys
Viena iš pagrindinių imunodeficito priežasčių sergant ŽIV infekcija yra masinė T pagalbininkų mirtis. Ji atsiranda dėl šių įvykių. Pirma, virusu užkrėsti T pagalbininkai žūsta dėl apoptozės. Manoma, kad AIDS sergantiems pacientams viruso replikacija, apoptozė ir T pagalbininkų skaičiaus sumažėjimas yra tarpusavyje susiję. Antra, T žudikai atpažįsta ir sunaikina virusu užkrėstas arba adsorbuotas gpl20 molekules turinčias T ląsteles, taip pat virusu užkrėstus ir neužkrėstus T pagalbininkus, kurie sudaro simplastus (sincitumą), sudarytus iš kelių dešimčių ląstelių (kai kurios iš jų žūsta dėl jose esančių virusų dauginimosi). Dėl daugybės T pagalbininkų sunaikinimo sumažėja B limfocitų membraninių receptorių interleukinui-2 raiška, sutrinka įvairių interleukinų (B limfocitų augimo ir diferenciacijos faktorių – IL-4, IL-5, IL-6 ir kt.) sintezė, todėl sutrinka T žudikų sistemos funkcija. Komplemento ir makrofagų sistemų aktyvumas slopinamas. Virusu užkrėsti makrofagai ir monocitai ilgai nežūsta, tačiau nesugeba pašalinti viruso iš organizmo. Galiausiai, dėl gpl20 struktūrinio ir antigeninio panašumo su kai kurių organizmo epitelio ląstelių receptoriais (įskaitant trofoblastų receptorius, tarpininkaujančius ŽIV perdavimui transplantacijos metu), sintetinami plataus veikimo spektro antireceptoriai. Tokie antikūnai geba blokuoti įvairius ląstelių receptorius ir apsunkinti ligos eigą autoimuniniais sutrikimais. ŽIV infekcijos pasekmė – visų pagrindinių imuninės sistemos grandžių pažeidimas. Tokie pacientai tampa beginkliai prieš įvairius mikroorganizmus. Tai veda prie oportunistinių infekcijų ir navikų vystymosi. Pacientams, sergantiems ŽIV infekcija, padidėja bent trijų tipų vėžio išsivystymo rizika: Kapoši sarkoma; karcinoma (įskaitant odos vėžį); B ląstelių limfoma, kuri atsiranda dėl piktybinės B limfocitų transformacijos. Tačiau ŽIV yra ne tik limfocitotropinis, bet ir neurotropinis. Jis prasiskverbia į centrinės nervų sistemos ląsteles (astrocitus) tiek receptorių sukeltos endocitozės būdu, tiek viruso užkrėstų limfoblastų fagocitozės būdu, kurį atlieka astrocitai. Kai virusas sąveikauja su astrocitais, susidaro ir simplastai, kurie palengvina patogeno plitimą tarpląsteliniais kanalais. Virusas ilgą laiką gali išlikti makrofaguose ir monocituose, todėl jie tarnauja kaip jo rezervuaras ir platintojai organizme, gebėdami prasiskverbti į visus audinius. Užkrėsti makrofagai vaidina svarbų vaidmenį ŽIV patekime į centrinę nervų sistemą ir ją pažeidžiant. 10 % pacientų pirminiai klinikiniai sindromai yra susiję su centrinės nervų sistemos pažeidimu ir pasireiškia kaip demencija. Taigi, ŽIV užsikrėtusiems žmonėms būdingos 3 ligų grupės – oportunistinės infekcijos,navikinės ligos ir centrinės nervų sistemos pažeidimai.
ŽIV infekcijos epidemiologija
ŽIV infekcijos šaltinis yra tik žmogus – sergantis asmuo arba viruso nešiotojas. Žmogaus imunodeficito virusas (ŽIV) yra kraujyje, spermoje, gimdos kaklelio skystyje; maitinančioms motinoms – motinos piene. Infekcija vyksta lytiniu keliu, per kraują ir jo preparatus, taip pat iš motinos vaikui prieš gimdymą, jo metu ir po jo. Užsikrėtimo virusu per maistą, gėrimus ir vabzdžių įkandimus atvejų nežinoma.
Narkotikų priklausomybė prisideda prie AIDS plitimo. ŽIV atvejų skaičius kasmet auga. Pasak PSO, nuo 1980 iki 2000 m. ŽIV užsikrėtė 58 mln. žmonių. Vien 2000 m. visame pasaulyje užsikrėtė 5,3 mln. žmonių, o 3 mln. žmonių mirė nuo AIDS. 2004 m. sausio 1 d. Rusijoje buvo užregistruota 264 tūkst. ŽIV infekuotų asmenų. Pusė ŽIV užsikrėtusių žmonių miršta per 11–12 metų nuo užsikrėtimo momento. 2004 m. pradžioje iš 100 tūkst. Rusijos piliečių apie 180 gyveno su „ŽIV infekcijos“ diagnoze. Prognozuojama, kad esant tokiam sergamumo lygiui, iki 2012 m. bendras ŽIV infekuotų žmonių skaičius Rusijoje bus 2,5–3 mln. žmonių. Kovos su ŽIV infekcija sudėtingumas priklauso nuo daugelio priežasčių: pirma, nėra veiksmingų jos gydymo ir specifinės prevencijos metodų; antra, ŽIV infekcijos inkubacinis laikotarpis gali viršyti 10 metų. Jo trukmė priklauso nuo T limfocito ir jo chromosomoje esančio DNR proviruso aktyvavimo momento. Vis dar neaišku, ar visi užsikrėtę virusu yra pasmerkti AIDS, ar įmanomas ilgalaikis viruso nešiojimas be ligos (kas atrodo mažai tikėtina). Galiausiai, yra keletas žmogaus imunodeficito virusų (ŽIV-1, ŽIV-2), kurių antigeniniai skirtumai neleidžia susidaryti kryžminiam imunitetui. Beždžionių imunodeficito viruso (SIV) atradimas nušvietė ŽIV kilmės klausimą. SIV savo genomo organizacija yra panašus į ŽIV, tačiau labai skiriasi savo nukleotidų seka. ŽIV-2 savo serologinėmis savybėmis užima tarpinę padėtį tarp ŽIV-1 ir SIV, o savo nukleotidų seka yra artimesnis SIV. Šiuo atžvilgiu V. M. Ždanovas teigė, kad ŽIV-1, ŽIV-2 ir SIV virusai kilo iš bendro protėvio. Pasak R. Gallo, gali būti, kad vienas iš SIV kažkaip pateko į žmogaus organizmą, kur patyrė mutacijų seriją, dėl kurios atsirado ŽIV-1, ŽIV-2 ir kitos jo formos.
ŽIV infekcijos simptomai
Žmogaus imunodeficito virusas turi keletą savybių, kurios daugiausia lemia ligos patogenezę. Virusas pasižymi labai dideliu dauginimosi greičiu, kurį lemia jo reguliavimo elementai (aktyvioje stadijoje per 5 minutes susintetinama iki 5000 virionų). Dėl susiliejusio baltymo (gp41) buvimo virusas sukelia didelių sincitinių struktūrų susidarymą dėl užkrėstų ir neužkrėstų T pagalbininkų susiliejimo, dėl ko jie masiškai žūsta. Dideliais kiekiais susidariusios gpl20 baltymo molekulės laisvai cirkuliuoja kraujyje ir jungiasi prie neužkrėstų T pagalbininkų receptorių, dėl ko jas taip pat atpažįsta ir sunaikina T žudikai. Virusas gali plisti tarpląsteliniais kanalais iš ląstelės į ląstelę, tokiu atveju jis tampa sunkiai prieinamas antikūnams.
Klinikiniai ŽIV infekcijos kriterijai
Suaugusiesiems ŽIV infekcija diagnozuojama, kai pasireiškia bent du sunkūs simptomai kartu su bent vienu nedideliu simptomu ir nėra kitų žinomų imunodeficito priežasčių (vėžys, įgimtas imunodeficitas, sunkus badavimas ir kt.). Sunkūs simptomai yra šie:
- svorio kritimas 10% ar daugiau;
- užsitęsusi karščiavimo būsena, protarpinė ar nuolatinė;
- lėtinis viduriavimas.
Nedideli simptomai: užsitęsęs kosulys, generalizuotas dermatitas, pasikartojanti juostinė pūslelinė, burnos ir ryklės kandidozė, lėtinė paprastoji pūslelinė, generalizuota limfadenopatija. AIDS diagnozė nustatoma esant tik Kapoši sarkomai, kriptokokiniam meningitui, pneumocistinei pneumonijai. Klinikinį ligos vaizdą įtakoja lydinti oportunistinė infekcija.
Žmogaus imunodeficito viruso (ŽIV) kultivavimo metodai
ŽIV-1 ir ŽIV-2 galima kultivuoti tik vieno TCV4 limfocitų klono – H9, gauto iš leukeminių TCV4 limfocitų, ląstelėse. Šiems tikslams taip pat gali būti naudojamos astrocitų ląstelių monosluoksnės kultūros, kuriose ŽIV-1 gerai dauginasi. Šimpanzės yra jautrios ŽIV-1 tarp gyvūnų.
Viruso atsparumas išorinėje aplinkoje yra mažas. Jis žūsta veikiamas saulės spindulių ir UV spindulių, sunaikinamas 80 °C temperatūroje per 30 minučių, o apdorojant įprastais dezinfekavimo priemonėmis – per 20–30 minučių. Norint dezinfekuoti virusą turinčią medžiagą, būtina naudoti mikobaktericidinius dezinfektantus, nes jie veiksmingi prieš atspariausius mikroorganizmus.
ŽIV infekcijos laboratorinė diagnostika
Pagrindinis viruso nešiojimo ir ŽIV infekcijos diagnozavimo metodas yra fermentinis imunologinis tyrimas. Tačiau dėl to, kad gpl20 turi struktūrinį ir antigeninį panašumą į kai kurių žmogaus ląstelių receptorius, įskaitant receptorius, kurie perneša imunoglobulinus per gleivinių epitelio ląsteles, organizme gali atsirasti antikūnų, susijusių su antikūnais prieš gpl20. Tokiu atveju gali būti klaidingai teigiami ELISA rezultatai. Todėl visi teigiamai reaguojantys tiriamųjų serumai papildomai analizuojami imunoblotavimo metodu arba Western blotavimo metodu. Šis metodas pagrįstas tiriamųjų antikūnų identifikavimu po jų elektroforezinio atskyrimo ir vėlesnio tyrimo naudojant žymėtus anti-rūšinius antikūnus. Virusologinis metodas retai naudojamas dėl viruso kultivavimo sudėtingumo. H9 limfocitų klonas naudojamas virusiniams antigenams – būtiniems diagnostinių tyrimų sistemų komponentams – gauti. CPR metodas leidžia aptikti virusą ankstyvoje viremijos stadijoje.
ŽIV infekcijos gydymas
Būtina rasti arba susintetinti vaistus, kurie veiksmingai slopintų atvirkštinės transkriptazės (revertazės) arba virusinės proteazės aktyvumą. Jie neleistų susidaryti DNR provirusui ir (arba) slopintų viruso ląstelėse dauginimąsi. Šiuolaikinė ŽIV infekuotų pacientų gydymo strategija pagrįsta vaistų, slopinančių virusinę proteazę (vieną iš vaistų) ir reverzazę (2 skirtingus vaistus), kombinuoto vartojimo principu – kombinuota (triguba) terapija. Rusijoje ŽIV infekuotiems pacientams gydyti rekomenduojama vartoti 2 vietinius vaistus: fosfazidą ir kriksivaną, kurie specifiškai slopina ŽIV dauginimąsi ankstyvoje ir vėlyvoje reprodukcijos stadijose, ypač sumažėjus azidotimidino aktyvumui.
Specifinės profilaktikos problema yra poreikis sukurti vakciną, kuri užtikrintų veiksmingo ląstelinio imuniteto, pagrįsto virusui būdingais citotoksiniais limfocitais, susidarymą be reikšmingos antikūnų gamybos. Tokį imunitetą suteikia Thl pagalbininkai. Gali būti, kad antikūnai, įskaitant virusus neutralizuojančius, ne tik neefektyviai slopina ŽIV infekciją, bet ir dideliu lygiu slopina ląstelinį imunitetą. Todėl vakcina nuo ŽIV pirmiausia turi atitikti du pagrindinius reikalavimus: a) būti absoliučiai saugi ir b) stimuliuoti T-citotoksinių limfocitų aktyvumą. Tiriamas įvairių vakcinos variantų, gautų iš užmuštų (inaktyvuotų) virusų ir iš atskirų antigenų, turinčių dideles apsaugines savybes, veiksmingumas. Tokie antigenai gali būti išskirti iš pačių virionų arba sintetinami cheminiu būdu. Pasiūlyta vakcina, sukurta remiantis genų inžinerijos metodais. Tai rekombinantinis vakcinijos virusas, turintis ŽIV genus, atsakingus už antigenų, turinčių stiprias imunogenines savybes, sintezę. Šių vakcinų veiksmingumo klausimas reikalauja daug laiko dėl ilgo ŽIV infekcijos inkubacinio laikotarpio ir didelio patogeno kintamumo. Labai veiksmingos vakcinos nuo ŽIV sukūrimas yra neatidėliotina esminė problema.

