Medicinos ekspertas
Naujos publikacijos
Vaikų pasiutligė
Paskutinį kartą peržiūrėta: 04.07.2025

Visas „iLive“ turinys yra peržiūrėtas medicinoje arba tikrinamas, kad būtų užtikrintas kuo didesnis faktinis tikslumas.
Mes turime griežtas įsigijimo gaires ir susiejamos tik su geros reputacijos žiniasklaidos svetainėmis, akademinių tyrimų institucijomis ir, jei įmanoma, medicininiu požiūriu peržiūrimais tyrimais. Atkreipkite dėmesį, kad skliausteliuose ([1], [2] ir tt) esantys numeriai yra paspaudžiami nuorodos į šias studijas.
Jei manote, kad bet koks mūsų turinys yra netikslus, pasenęs arba kitaip abejotinas, pasirinkite jį ir paspauskite Ctrl + Enter.
Pasiutligė, arba hidrofobija, yra ūminė virusinė liga, perduodama per užkrėsto gyvūno įkandimą, pažeidžianti nervų sistemą ir sukelianti sunkią encefalito formą, kurios baigtis mirtina.
Epidemiologija
Nuo seniausių laikų visuomenės sveikatos rykštė – pasiutligės virusas, šiuo metu kasmet sukelia maždaug 59 000 žmonių mirčių, beveik visas šias mirtis perduodama įkandus šunims. Tai daro didelį ekonominį poveikį besivystančioms šalims, ypač Afrikoje ir Azijoje, kurios gali patirti mažiausiai tokių nuostolių. Tačiau, nepaisant beveik 100 % mirtingumo, šunų pasiutligė yra visiškai išvengiama liga, ir tai patvirtina istoriniai šunų pasiutligės išnaikinimo išsivysčiusiose šalyse pavyzdžiai. [ 1 ]
Priežastys pasiutligė
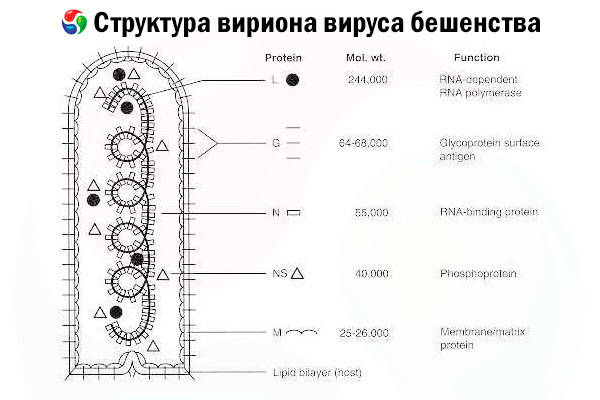
Sukėlėjas yra pasiutligės virusas (RV) – neigiamos grandinės RNR virusas, priklausantis rabdovirusų šeimai, kurio dydis yra maždaug 60 nm × 180 nm.
Jį sudaro vidinis baltymo branduolys arba nukleokapsidė, kurioje yra nukleorūgštis, ir išorinė membrana – lipidų turintis dvigubas sluoksnis, padengtas transmembraniniais glikoproteinų smaigaliais. Jis turi gana paprastą modulinę genomo struktūrą ir koduoja penkis struktūrinius baltymus:
- RNR priklausoma RNR polimerazė (L),
- nukleoproteinas (N),
- fosforilintas baltymas (P),
- matricos baltymas (M) ir
- išorinio paviršiaus glikoproteinas (G).
N, P ir L baltymai kartu su genomine RNR sudaro ribonukleoproteinų kompleksą. G yra vienintelis RV antigenas, galintis sukelti RV neutralizuojančių antikūnų, kurie yra pagrindiniai imuniniai efektoriai prieš mirtiną RV infekciją, gamybą. Kita vertus, įrodyta, kad ribonukleoproteinų kompleksas yra pagrindinis RV antigenas, galintis sukelti CD4+ T ląsteles, kurios gali sustiprinti RV neutralizuojančių antikūnų gamybą per intrastruktūrinį antigeno atpažinimą.[ 2 ] Ribonukleoproteinų kompleksas gali atlikti svarbų vaidmenį kuriant imunologinę atmintį ir ilgalaikį imunitetą.[ 3 ]
Klasifikacija ir antigenų tipai
Lyssavirus genčiai priklauso pasiutligės virusas ir antigeniškai bei genetiškai susiję pasiutligės virusai: Lagoso, Mokolos ir Duvenhago šikšnosparnių virusai, taip pat du galimi europinių šikšnosparnių lysavirusų potipiai. Kryžminės apsaugos tyrimai rodo, kad gyvūnai, imunizuoti tradicinėmis pasiutligės vakcinomis, gali būti nevisiškai apsaugoti, kai jie užkrečiami kitais lysavirusais.
Pasiutligės virusai gali būti klasifikuojami kaip fiksuoti (adaptuoti perėjimo į gyvūnus arba ląstelių kultūrą būdu) arba gatvės (laukinio tipo). Monokloninių antikūnų ir genetinio sekoskaitos naudojimas gatvės pasiutligės virusams diferencijuoti padėjo identifikuoti viruso variantus, kilusius iš pagrindinių šeimininkų rezervuarų visame pasaulyje, ir pasiūlyti galimus žmonių sąlyčio šaltinius, kai paciento atveju nebuvo jokio gyvūno įkandimo.[ 8 ]
Pathogenesis
Pagrindinis infekcijos šaltinis ir rezervuaras tarp laukinių gyvūnų yra vilkai, lapės, šakalai, šikšnosparniai, o tarp naminių gyvūnų – šunys ir katės, retai – arkliai, galvijai, kiaulės, žiurkės ir kt. Infekcijos perdavimas iš žmogaus žmogui, nors ir įmanomas, yra itin retas. Tai tipiška zoonozinė infekcija. Žmonės pasiutlige užsikrečia daugiausia nuo šunų.
Sergančiam gyvūnui įkandus, virusas dauginasi įkandimo vietos raumeniniame audinyje, o vėliau, pasiekęs sensorinių periferinių nervų galus, plinta įcentriškai, pasiekdamas motorinius neuronus. Laikas, per kurį virusas juda ir pažeidžiamos smegenys, priklauso nuo įkandimo vietos. Esant stipriems galvos ir veido įkandimams, virusas centrinę nervų sistemą gali pasiekti per 15–20 dienų, o esant nedideliam liemens ir galūnių odos pažeidimui ir dėl to nedidelei patogeno dozei, viruso perkėlimo į centrinę nervų sistemą procesas gali būti atidėtas keliems mėnesiams ar net iki 1–1,5 metų. Pasiekęs centrinę nervų sistemą, virusas pritvirtinamas galvos ir nugaros smegenų audiniuose, daugiausia pailgųjų smegenų, Amono rago ir smegenų pagrindo neuronuose. Nugaros smegenyse labiausiai pažeidžiami užpakaliniai ragai. Iš centrinės nervų sistemos virusas išcentriniu būdu palei nervų kamienus pasiekia seilių liaukas, kur dauginasi ir išsiskiria su seilėmis.
Pasiutligės patogenezės sąvokos
RV turi platų šeimininkų spektrą ir gali užkrėsti beveik visus žinduolius. Nors pranešta apie kelis RV perdavimo būdus, natūrali infekcija dažniausiai įvyksta per įkandimą. Be įkandimų, RV užkrėstų gaišenų valgymas gali paskatinti pasiutligės viruso infekciją arktinėms lapėms, o RV sąlytis su gleivinėmis yra dar vienas galimas perdavimo būdas.[ 9 ] Kai kuriomis neįprastomis aplinkybėmis, pavyzdžiui, atsitiktiniu RV išleidimu aerozolio pavidalu laboratorijoje arba RV aerozolio pavidalu urvuose, kuriuose gyvena daugybė šikšnosparnių,[ 10 ] gali įvykti aerozolio perdavimas.
Kol kas neaišku, ar gatvės RV ir prie pelių, ar prie audinių kultūrų adaptuoti RV kamienai replikuojasi inokuliacijos vietoje prieš patekdami į CNS. Nors eksperimentinė jauniklių žiurkėnų ar meškėnų intramuskulinė gatvės RV infekcija atskleidė RV replikaciją ruožuotosiose raumenų ląstelėse prieš virusui įsiskverbiant į motorinių neuronų aksonus per neuromuskulines jungtis[ 11 ],[ 12 ] pelių intramuskulinė infekcija su prie pelių adaptuotu CVS-24 RV parodė, kad RV migruoja tiesiai į CNS be išankstinės replikacijos inokuliacijos vietoje.[ 13 ] Patekęs į nemielinizuotų aksonų galus, RV retrogradiškai transportuojamas į ląstelės kūną.
Naujausi tyrimai rodo, kad aksonų pūslelių pernaša gali būti pagrindinė virionų judėjimo dideliais atstumais aksonuose strategija.[ 14 ] Apskaičiuota, kad RV migruoja aksonuose 3 mm/h greičiu.[ 15 ] Tada infekcija plinta per neuronų grandinę, sujungtą sinapsinėmis jungtimis. Tačiau tikslus mechanizmas, skatinantis transsinapsinį plitimą, vis dar nežinomas. Užkrėtęs smegenis, virusas išcentriniu būdu plinta į periferinę ir autonominę nervų sistemą daugelyje periferinių organų.[ 16 ] Paskutiniame infekcijos ciklo etape RV migruoja į seilių liaukas; po replikacijos mukogeninėse acinarinėse ląstelėse jis išsiskiria į seiles ir yra paruoštas perdavimui kitam šeimininkui.[ 17 ]
Kalbant apie pasiutligės viruso sukeltą patologiją, apoptozinė ląstelių mirtis buvo pasiūlyta kaip galimas patogeninis mechanizmas eksperimentiniuose pelių, užkrėstų fiksuota RV paderme, pasiutligės modeliuose.[ 18 ] Patogenetinis mechanizmas, galintis prisidėti prie pasiutligei būdingo ryškaus CNS disfunkcijos, gali būti sutrikusi neuronų funkcija. Nustatyta, kad RV užkrėstuose neuronuose genų raiška yra žymiai sumažėjusi, todėl apskritai slopinama baltymų sintezė,[ 19 ] ir keli tyrimai parodė sutrikusią neurotransmisiją po RV infekcijos. Jiang parodė, kad acetilcholino receptorių antagonisto prisijungimas prie užkrėstų žiurkių smegenų homogenatų buvo sumažėjęs, palyginti su kontrolinėmis grupėmis.[ 20 ] RV užkrėstose žiurkių smegenyse taip pat buvo pastebėtas sutrikęs serotonino, neuromediatoriaus, dalyvaujančio miego ciklo, skausmo suvokimo ir elgesio kontrolėje, išsiskyrimas ir prisijungimas.[ 21 ], [ 22 ] Be neurotransmisijos poveikio, dešiniojo skilvelio infekcija taip pat gali paveikti jonų kanalus. Užkrėstose pelių neuroblastomos ląstelėse sumažėja įtampos reguliuojamų natrio kanalų funkcinė raiška, o tai gali užkirsti kelią veikimo potencialams ir galiausiai sukelti funkcinį sutrikimą.[ 23 ]
Be to, kad nėra rimtų patologinių pažeidimų CNS, dauguma žmonių pasiutligės atvejų nesukelia imuninio atsako praėjus 7–10 dienų nuo klinikinių požymių atsiradimo. Šiuos didelius skirtumus tarp pasiutligės patogenezės ir daugelio kitų virusinių ar bakterinių CNS infekcijų dar labiau patvirtina faktas, kad imunosupresija yra arba neefektyvi, arba žalinga pasiutligės baigčiai.[ 24 ] Žemas imuninio atsako lygis, dažnai stebimas pasiutligės aukoms, kelia mįslę, nes jo negalima paaiškinti silpnu RV antigenų imunogeniškumu. Iš tiesų, RV G ir nukleokapsidės baltymas yra stiprūs B ir T ląstelių antigenai, kai jie skiriami parenteraliai. [ 25 ] Galimas žemo imuninio atsako prieš RV laipsnio paaiškinimas žmonėms ar gyvūnams, sergantiems pasiutlige, gali būti tas, kad RV infekcija CNS sukelia imunosupresiją [ 26 ], ir buvo pasiūlyta, kad RV naudoja subversyvią strategiją, įskaitant apoptozės prevenciją ir invazinių T ląstelių sunaikinimą. [ 27 ]
Susilpnintos RV padermės, prisitaikiusios prie neneuroninių ląstelių, labai skiriasi nuo patogeninių gatvės RV padermių savo neuroinvazyvumu, kuris reiškia jų gebėjimą prasiskverbti į CNS iš periferinių vietų. Šiuo atžvilgiu audinių kultūroms pritaikytos RV padermės arba neturi, arba turi tik ribotą gebėjimą prasiskverbti į CNS iš periferinių vietų, tuo tarpu gatvės RV padermės arba prie pelių adaptuotos RV padermės, tokios kaip CVS-24, yra labai invazinės.[ 28 ] Pagrindiniai RV neuroinvazijos veiksniai yra viruso patekimas, aksonų pernaša, transsinapsinis plitimas ir viruso replikacijos greitis.
Iki šiol mūsų žinios apie RV patogenezę buvo ribotos ir daugiausia rėmėsi aprašomaisiais gatvėse paplitusių RV padermių arba eksperimentinių infekcijų su laboratorijoje adaptuotomis susilpnintomis padermėmis tyrimais. Atvirkštinės genetikos technologijos atsiradimas leido mums nustatyti virusinius elementus, lemiančius patogeninį RV fenotipą, ir geriau suprasti pasiutligės patogenezės mechanizmus.
Virusinių elementų, kontroliuojančių pasiutligės viruso įgijimą, plitimą ir replikaciją, identifikavimas
- Virusiniai elementai, susiję su viruso gaudymu
RV infekcija prasideda virusui prisijungus prie tariamo ląstelinio receptoriaus. Nors kelios membranos paviršiaus molekulės buvo pasiūlytos kaip RV receptoriai, įskaitant nikotininį acetilcholino receptorių,[ 29 ] nervinių ląstelių adhezijos molekulę[ 30 ] ir mažo afiniteto neurotrofinų receptorių p75 NTR,[ 31 ] vis dar neaišku, ar šios molekulės iš tikrųjų atlieka vaidmenį pasiutligės viruso gyvavimo cikle. Atsižvelgiant į tai, neseniai buvo įrodyta, kad RV G ir p75 NTR sąveika nėra būtina pirminių neuronų RV infekcijai.[ 32 ] Prisijungęs prie receptoriaus, RV yra internalizuojamas adsorbcinės arba receptorių sukeltos endocitozės būdu.[ 33 ] Žemo pH aplinka endosominiame skyriuje sukelia RV G konformacinius pokyčius, kurie sukelia viruso membranos susiliejimą su endosomine membrana, taip išlaisvindama RNP į citoplazmą.[ 34 ] Virusams RV G atlieka labai svarbų vaidmenį viruso pasisavinime, greičiausiai per sąveiką su tariamais ląstelių receptoriais, kurie skatina greitą pasisavinimą. Šiuo atžvilgiu buvo įrodyta, kad audinių kultūroms pritaikytų RV padermių (pvz., ERA, HEP ir CVS-11) patogeniškumas koreliuoja su determinanto, esančio G baltymo III antigeninėje srityje, buvimu. [ 35 ] Arg → Gln mutacija 333 pozicijoje šioje ERA G baltymo antigeninėje srityje lėmė septynis kartus vėlesnį Gln333 RV varianto internalizavimą, palyginti su laukinio tipo variantu. Asn194→Lys194 mutacija RV G viripse, paaiškinanti patogeninio fenotipo pakartotinį atsiradimą, buvo susijusi su reikšmingu internalizacijos laiko sutrumpėjimu.[ 36 ] Be to, eksperimentai su chimeriniais RV parodė, kad RV virionų internalizacijai reikalingas laikas reikšmingai pailgėjo, o patogeniškumas labai sumažėjo pakeitus labai patogeniškos SB RV padermės, gautos iš sidabro kilmės šikšnosparnių RV-18 padermės kDNR klono,[ 37 ] G geną labai susilpnintos SN padermės, išskirtos iš SAD B19 RV vakcinos padermės kDNR klono, genu.[ 38 ] Šie duomenys kartu patvirtina mintį, kad viruso įsisavinimo kinetika, kuri yra RV G funkcija, yra pagrindinis RV patogeniškumo veiksnys.
- Virusiniai elementai, susiję su virusų plitimu ir perdavimu
Unikali pasiutligės viruso savybė yra jo gebėjimas plisti iš ląstelės į ląstelę. Pastebėjimas, kad Gln333 ERA variantas in vitro praranda nuo pH priklausomą ląstelių susiliejimo aktyvumą [ 39 ] ir pasižymi labai sumažėjusiu gebėjimu plisti iš ląstelės į ląstelę [ 40 ], rodo, kad RV G taip pat vaidina pagrindinį vaidmenį plintant iš ląstelės į ląstelę ir tokiu būdu perduodant virusą, greičiausiai dėl savo fuziogeninio aktyvumo. Šią galimybę dar labiau patvirtina tai, kad patogeninio RV grįžtamojo SPBNGAK plitimo greitis yra beveik dvigubai didesnis nei nustatytas nepatogeninio SPBNGAK varianto. Įdomu tai, kad Asn 194 → Lys 194 mutacija G SPBNGAK sukėlė pH slenksčio membranų susiliejimui poslinkį į aukštesnį pH, patvirtindama hipotezę, kad aukštesnė pH slenkstis membranų susiliejimui yra susijusi su padidėjusiu viruso plitimu [ 41 ].
Transneuroninių RV infekcijos rodiklių tyrimai su žiurkėmis [ 42 ] ir rezus beždžionėmis [ 43 ] parodė, kad pasiutligės virusas migruoja tik retrogradine kryptimi aksonais. Nors keli RV baltymai dalyvauja neuronų pernašos mechanizmuose, atrodo, kad RV G vaidina vyraujantį vaidmenį transneuroniniame RV infekcijos plitime. Pavyzdžiui, nors periferinė infekcija arklių infekcinės anemijos virusu (EIAV), pseudotipizuotas RV G, sukelia viruso perdavimą į nugaros smegenis, tas pats EIAV, pseudotipizuotas vezikulinio stomatito virusu G, nepateko į nervų sistemą. [ 44 ] Be to, nustatyta, kad ERA G Arg 333 → Gln 333 mutanto virusinis plitimas CNS yra labai sumažėjęs, palyginti su laukinio tipo mutantu, o tai dar labiau rodo nepažeisto RV G funkciją transsinapsiniame plitime. Vis dėlto įtikinamiausi įrodymai apie svarbų RV G vaidmenį transsinapsinėje pernašoje gauti iš intrakranijinės pelių infekcijos rekombinantiniu G stokojančiu RV virusu, kuris parodė, kad infekcija apsiribojo neuronais inokuliacijos vietoje, be jokių išplitimo į antrinius neuronus požymių.[ 45 ] Tačiau tikėtina, kad be RV G, RV M taip pat atlieka svarbų vaidmenį viruso plitime ir, atitinkamai, transsinapsinėje pernašoje. Šiuo atžvilgiu buvo parodyta, kad chimerinio SN-BMBG RV varianto, kuriame yra ir M, ir G iš labai patogeniško SB, plitimas buvo žymiai didesnis nei chimerinio SN-BG arba SN-BM varianto, kuriuose yra atitinkamai G ir M iš SB, plitimas, o tai rodo, kad optimali M sąveika su G gali atlikti svarbų vaidmenį viruso plitime iš ląstelės į ląstelę. [ 46 ] Kadangi RV M palaiko viruso pumpuravimąsi, [ 47 ] tikėtina, kad efektyvesnis chimerinio RV SN-BMBG varianto plitimas yra dėl optimalaus viruso pumpuravimosi posinapsinėje membranoje.
Naujausi tyrimai parodė, kad RV P ir dineino lengvosios grandinės sąveika sujungia RV RNP su šeimininko ląstelės pernašos sistema, taip palengvindama viruso retrogradinį aksonų pernašą.[ 48 ],[ 49 ] Tačiau suaugusių pelių periferinė infekcija parodė, kad RV P LC8 surišančiojo domeno ištrynimas neužkerta kelio viruso patekimui į CNS, o tai rodo, kad RV baltymas tiesiogiai nedalyvauja RV retrogradiniame aksonų plitime.[ 50 ]
- Virusiniai elementai, kontroliuojantys viruso replikaciją
Skirtingai nuo daugelio kitų virusų, tokių kaip gripo virusas, RV patogeniškumas yra atvirkščiai proporcingas virusinės RNR sintezės greičiui ir infekcinių virusinių dalelių gamybai. Palyginus skirtingų chimerinių virusų gaminamų virusinių mRNR ir genominių RNR lygius, galima teigti, kad virusinės RNR transkripciją ir replikaciją reguliuoja daug veiksnių, įskaitant RV M, kuris buvo identifikuotas kaip transaktyvus faktorius, tarpininkaujantis perėjimui nuo pradinio aukšto mRNR sintezės lygio prie genominės RNR sintezės.[ 51 ] Be to, visų rabdovirusų M gali nutraukti virusinių genų ekspresiją, prisijungdamas prie RNP, todėl susidaro labai kondensuota, į pagrindą panaši struktūra, kuri negali palaikyti RNR sintezės.
Siekiant nustatyti kitus virusinius elementus, kurie kontroliuoja patogeniškumą reguliuodami viruso replikaciją, labai patogeniškos SB padermės 5' galinės sekos buvo palaipsniui pakeistos sekomis iš labai susilpnintos SN vakcinos padermės, gaunant rekombinantinius virusus SB2 (galinė seka [TS] + L), SB3 (TS + L + pseudogenas [Ψ]), SB4 (TS + L + Ψ + G) ir SB5 (TS + L + Ψ + G + M). Intramuskulinė infekcija pirminiais SB ir SN virusais bei chimeriniais RV SB2, SB3, SB4 ir SB5 sukėlė didžiausią mirtingumą SB infekuotoms pelėms ir jokio sergamumo ar mirtingumo SN infekuotoms pelėms. TS, L ir SB pakeitimas atitinkamais SN elementais lėmė nedidelį sergamumo ir mirtingumo sumažėjimą, o papildomas G arba G ir M pakeitimas stipriai sumažino arba visiškai panaikino virusinį patogeniškumą.
Šių laukinio tipo ir chimerinių RV fenotipinis apibūdinimas audinių kultūroje parodė, kad tam tikro RV patogeniškumas yra atvirkščiai koreliuojamas su jo gebėjimu replikuotis neuroninėse ląstelėse. Nors SB replikacijos lygis buvo beveik 1000 kartų mažesnis nei SN, o TS, L ir SB pakeitimas SN lygiais mažai paveikė viruso augimo kinetiką, papildomas SB G arba G ir M pakeitimas atitinkamais SN genais lėmė 1 log padidėjimą viruso gamyboje, o tai rodo, kad virusinės RNR replikacijos kinetiką, taip pat virusinių dalelių gamybą daugiausia kontroliuoja RV G baltymas. Šią išvadą patvirtina duomenys, gauti su RV G variantais, kurie skiriasi viena aminorūgštimi savo G baltymuose. Patogeninis pasiutligės viruso variantas SPBNGAK 194 NA ląstelėse sukėlė 1 log mažesnį viruso titrą nei nepatogeninis variantas SPBNGAK 194, o realaus laiko PGR analizė parodė, kad virusinės RNR transkripcijos ir replikacijos greitis SPBNGAK užkrėstose NA ląstelėse buvo 5 ir 10 kartų didesnis nei SPBNGAK užkrėstose NA ląstelėse.[ 52 ] Dar daugiau įrodymų apie atvirkštinę koreliaciją tarp patogeniškumo ir virusinės RNR sintezės bei virusinių dalelių gamybos greičio pateikė pelės, užkrėstos chimeriniais rekombinantiniais virusais, kuriuose susilpnintos SN padermės G ir M genai buvo pakeisti labai patogeniškos SB padermės genais. Šie eksperimentai atskleidė reikšmingą tėvinės SN padermės, turinčios RV G, patogeniškumo padidėjimą, palyginti su patogenine SB paderme. Patogeniškumas dar labiau padidėjo, kai į SN buvo įvesti ir G, ir M iš SB.
G arba M arba abiejų pakeitimas SN genuose atitinkamais SB genais buvo susijęs su reikšmingu virusinių dalelių gamybos greičio ir virusinės RNR sintezės greičio sumažėjimu. Šie duomenys rodo, kad ir G, ir M atlieka svarbų vaidmenį RV patogenezėje, reguliuodami viruso replikaciją. Tai, kad G arba G ir M pakeitimas SN genuose G arba G ir M iš SB lemia atitinkamai vidutinį arba stiprų virusinės RNR transkripcijos ir replikacijos sumažėjimą, o vien M pakeitimas SN genuose SB M lemia stiprų virusinės RNR transkripcijos ir replikacijos padidėjimą, rodo, kad RV G genas taip pat atlieka svarbią reguliavimo funkciją virusinės RNR transkripcijoje / replikacijoje, vienas arba sąveikaudamas su M baltymu. Mechanizmas, kuriuo RV G genas kontroliuoja virusinės RNR sintezę, nežinomas. Tam tikros RV G genų nukleotidų sekos, pavyzdžiui, tos, kurios apima Arg333 ir Lys 194 kodonus, buvo identifikuotos kaip ląstelinių miRNR taikiniai. Įrodyta, kad taikinių atpažinimas ląstelinių miRNR gali lemti teigiamą arba neigiamą viruso replikacijos reguliavimą. [ 53 ] Arg 333 → Glu 333 arba Lys 194 → Ser 194 pakeitimai RV G geno sekoje lemia miRNR taikinių sekų panaikinimą, o tai savo ruožtu yra susiję su reikšmingu virusinės RNR sintezės greičio padidėjimu [Faber M, Thomas Jefferson universitetas, PA, JAV, nepublikuoti duomenys], o tai rodo, kad šeimininko ląstelių miRNR taip pat atlieka svarbų vaidmenį reguliuojant RV replikaciją, kaip buvo įrodyta kitų RNR virusų, įskaitant vezikulinio stomatito virusą ir HCV, atveju. [ 54 ], [ 55 ]
Virusų replikacijos reguliavimas atrodo esąs vienas iš svarbių RV patogenezės mechanizmų. Siekdamos išvengti imuninio atsako ir išsaugoti neuronų tinklo vientisumą, patogeninės RV padermės, bet ne susilpnintos padermės, gali reguliuoti savo augimo greitį. Mažesnis replikacijos greitis greičiausiai yra naudingas patogeninėms RV padermėms, nes išsaugo neuronų struktūrą, kurią šie virusai naudoja pasiekdami CNS. Kitas patogeninių RV replikacijos greičio sumažėjimo paaiškinimas yra tas, kad siekdamas išvengti ankstyvo aptikimo šeimininko imuninėje sistemoje, virusas palaiko minimalų savo antigenų ekspresijos lygį.
RV G ekspresijos, apoptozės ir patogeniškumo ryšys
Gerai žinoma, kad gatvės pasiutligės viruso padermės, kurios yra žymiai patogeniškesnės nei audinių kultūroms pritaikytos padermės, išreiškia labai ribotą G kiekį ir nesukelia apoptozės iki vėlyvo infekcijos ciklo etapo. Tai rodo, kad konkretaus viruso padermės patogeniškumas yra atvirkščiai proporcingas RV G ekspresijai ir gebėjimui sukelti apoptozę.[ 56 ] Tiesioginiai įrodymai apie koreliaciją tarp G ekspresijos lygio ir apoptozės masto buvo gauti su rekombinantiniu RV SPBNGA-GA, kuris turėjo du identiškus G genus ir padidino RV G ekspresiją.[ 57 ] Šiuo rekombinantiniu RV užkrėstų neuronų kultūrų morfologiniai tyrimai parodė, kad ląstelių žūtis reikšmingai padidėjo kartu su RV G perraiška ir kad apoptozė yra pagrindinis mechanizmas, susijęs su RV G sukelta mirtimi. Visų pirma, F-aktino dažymo sumažėjimas po SPBNGA-GA infekcijos atitinka apoptozės sukeltą aktino filamentų depolimerizaciją. Be to, TUNEL teigiamų branduolių skaičius SPBNGA-GA užkrėstuose neuronuose buvo reikšmingai padidėjęs, palyginti su neužkrėstais ir SPBNGA užkrėstais neuronais. Tačiau mechanizmas, kuriuo RV G genas tarpininkauja apoptozės signalizacijos procese, vis dar nežinomas. Teigiama, kad RV G raiška, viršijanti tam tikrą ribą, smarkiai sutrikdo ląstelės membraną. Labai tikėtina, kad apoptozės ląstelės nėra greitai pašalinamos CNS ir todėl patiria antrinę nekrozę. [ 58 ] Kita vertus, RV infekcija ir ypač RV G baltymo perteklinė raiška gali sukelti piroptozę – ląstelių mirties kelią, panašų į apoptozę, kuris, skirtingai nei apoptozė, apima kaspazės 1 aktyvaciją ir taip sukelia nekrozę. [ 59 ] RV infekcijos sukeltos nekrozės arba piroptozės laipsnis greičiausiai vaidina lemiamą vaidmenį antivirusinio imuniteto indukcijoje. Nors apoptozės ląstelės išlaiko savo membranos vientisumą ir nestimuliuoja įgimto imuninio atsako, nekrozinės ląstelės tampa pralaidžios ir išskiria endogeninius adjuvantus, kurie gali sukelti stiprų įgimtą imuninį atsaką. [ 60 ]
Kadangi apoptozės/nekrozės lygis koreliuoja su RV imunogeniškumu, buvo teigiama, kad apoptozės/nekrozės ląstelių imunostimuliacinis poveikis greičiausiai prisideda prie apsauginio imuninio atsako susidarymo. Todėl RV G ekspresijos reguliavimas labai tikėtina yra svarbus pasiutligės patogenezės veiksnys, nes jis suteikia galimybę patogeniniams RV variantams išgyventi ir plisti nervų sistemoje nesukeliant akivaizdaus neuronų pažeidimo ir nesukeliant apsauginio imuninio atsako, kuris užkirstų kelią infekcijai.
RV G raiška gali būti reguliuojama RNR sintezės, potransliacijos arba abiem lygmenimis. Nustatyta, kad skirtingų chimerinių RV variantų ekspresuojamo RV G lygiai atsispindi virusinės RNR sintezės greičiu, o tai rodo, kad skirtingas RV G raiškos reguliavimas šiuose variantuose atsiranda dėl virusinės mRNR transkripcijos greičio skirtumų. Kaip ir virusinės RNR transkripcijos greičio atveju, šių variantų ekspresuojamas RV G kiekis atvirkščiai koreliuoja su viruso patogeniškumu. Kita vertus, pirminių neuronų kultūrų infekcija mažiau patogenišku RV variantu CVS-B2c lėmė keturis kartus didesnį G baltymo kiekį nei infekcija labai patogenišku CVS-N2c variantu, nepaisant panašaus G mRNR kiekio sintezės abiejose infekcijose. Impulso eksperimentai parodė, kad didesnis G baltymo kiekis CVS-B2c infekuotuose neuronuose daugiausia buvo lėtesnio CVS-B2c G baltymo skaidymo greičio, palyginti su CVS-N2c G baltymu, rezultatas. Tačiau mechanizmas, lemiantis greitesnį CVS-N2c G baltymo proteolitinį skaidymą, dar nėra išaiškintas.
Simptomai pasiutligė
Pasiutligės inkubacinis periodas vidutiniškai trunka 30–90 dienų. Esant masinei infekcijai per dideles galvos ir veido žaizdas, jis gali sutrumpėti iki 12 dienų. Retais atvejais inkubacinis periodas gali trukti 1 metus ar ilgiau.
Yra griežtai nuoseklus trijų ligos laikotarpių pokytis: prodrominis, sužadinimo, paralyžiaus.
Prodrominis periodas prasideda nuo skausmo įkandimo vietoje ar nervų srityje, taip pat skausmo. Rando srityje gali būti deginimo pojūtis, niežulys, kartais paraudimas ir patinimas. Pacientui pasireiškia bendras negalavimas, galvos skausmas, pykinimas. Vėmimas, kūno temperatūros padidėjimas iki 37,5–38 °C ir progresuojančio psichikos sutrikimo simptomai: padidėjęs refleksinis jaudrumas, nepaaiškinamas nerimo, baimės, melancholijos jausmas. Dažnai pacientas būna prislėgtas, slopinamas, užsisklendęs, atsisako valgyti, blogai miega, skundžiasi niūriomis mintimis, bauginančiais sapnais. Prodrominis periodas trunka 2–3 dienas, kartais pratęsiamas iki 7 dienų. Šio laikotarpio pabaigoje gali pasireikšti nerimo priepuoliai su trumpalaikiais kvėpavimo sunkumais, krūtinės spaudimo jausmu, lydimu tachikardijos ir padažnėjusio kvėpavimo.
Susijaudinimo periodui būdingas hidrofobijos atsiradimas: bandant atsigerti, o vėliau pamatęs vandenį ar jį primenantį, pacientas patiria konvulsinį ryklės ir gerklų spazmą, kurio metu jis su riksmu išmeta puodelį vandens, drebančiomis rankomis atmeta į priekį, atmeta galvą ir kūną. Kaklas ištemptas, veidą iškreipia skausminga grimasa, kuri dėl kvėpavimo raumenų spazmo tampa melsva. Akys išpūstos, išreiškiama baimė, prašoma pagalbos, vyzdžiai išsiplėtę, sunku įkvėpti. Priepuolio įkarštyje galimas širdies ir kvėpavimo sustojimas. Priepuolis trunka kelias sekundes, po kurio paciento būklė, atrodo, pagerėja. Vėliau gerklų ir ryklės raumenų spazmų priepuoliai gali kilti net nuo oro judėjimo (aerofobija), ryškios šviesos (fotofobija) ar garsaus žodžio (akustofobija). Priepuolius lydi psichomotorinis sujaudinimas, kurio metu pacientas elgiasi kaip „beprotis“. Priepuolio metu sąmonė aptemusi, tačiau tarp priepuolių ji prablaivėja. Sujaudinimo laikotarpiu dėl padidėjusio simpatinės nervų sistemos tonuso pacientams smarkiai padidėja seilėtekis (sialorėja), dėl ryklės raumenų spazmo negalima nuryti seilių. Pacientas purškiasi seilėmis. Kai kuriems pacientams gali pasireikšti meningizmo ir net opistotonuso požymiai, dažnai pasitaiko traukuliai. Tokiu atveju smegenų skystis gali nepakisti, tačiau kai kuriems pacientams dėl limfocitų gali padidėti baltymų koncentracija, o ląstelių skaičius – padidėjęs.
Nesant tinkamo gydymo, sustiprėja dehidratacijos požymiai, veido bruožai tampa ryškesni, mažėja kūno svoris. Kūno temperatūra pakyla iki aukštų verčių. Galimi traukuliai. Sužadinimo stadijos trukmė yra apie 2–3 dienas, retai – 4–5 dienas. Mirtina baigtis paprastai įvyksta vieno iš priepuolių metu. Retai pacientas išgyvena iki trečiosios ligos stadijos.
Paralyžiaus laikotarpiu pacientas nurimsta. Hidrofobijos priepuoliai liaujasi, pacientas gali gerti ir nuryti maistą, sąmonė skaidri. Tačiau nepaisant akivaizdžios gerovės, netrukus atsiranda letargija, apatija, depresija, galūnių paralyžius, dubens sutrikimai, galvinių nervų paralyžius. Kūno temperatūra pakyla iki 42–43 °C, sumažėja arterinis slėgis, o jau pirmos dienos pabaigoje ištinka mirtis dėl širdies ir kraujagyslių bei kvėpavimo centrų paralyžiaus.
Periferiniame kraujyje stebima neutrofilinė leukocitozė, padidėjęs hemoglobino, eritrocitų ir hematokrito kiekis.
Kas tau kelia nerimą?
Formos
Kliniškai skiriamos tipinės ir netipinės formos. Netipinėms formoms priskiriami visi atvejai be susijaudinimo ir hidrofobijos. Netipinėms formoms priskiriamos bulbarinės, smegenėlių, meningoencefalitinės ir kt.
Diagnostika pasiutligė
Pasiutligės diagnozę galima nustatyti nustatant pasiutligės antigeną, antikūnus, virusinę RNR arba išskiriant virusą. Kadangi bet kuris individualus tyrimas pacientui, sergančiam pasiutlige, gali būti neigiamas, kartais būtina atlikti serijinius serumo mėginius pasiutligės antikūnams nustatyti, seilių mėginius viruso kultūrai ir odos biopsiją tiesioginiam imunofluorescenciniam viruso antigeno tyrimui, ypač kai labai įtariama pasiutligė.
Vienas iš greičiausių būdų diagnozuoti pasiutligę prieš mirtį žmonėms yra atlikti tiesioginį imunofluorescencinį testą su sprando odos biopsija, siekiant nustatyti pasiutligės antigeną. Tiesioginis imunofluorescencinis testas yra jautriausias ir specifiškiausias metodas pasiutligės antigenui nustatyti odoje ir kituose šviežiuose audiniuose (pvz., smegenų biopsijoje), nors ligos pradžioje rezultatai kartais gali būti neigiami. Jei šviežio audinio nėra, fiksuotų audinių fermentinis virškinimas gali padidinti imunofluorescencinio testo reaktyvumą; tačiau jautrumas gali būti nepriimtinai mažas.
Diagnozę taip pat galima nustatyti, jei virusas išskiriamas iš seilių po neuroblastomos ląstelių arba laboratorinių graužikų inokuliacijos; tai paprastai veiksmingiausia per pirmąsias 2–3 ligos savaites. Pasiutligės virusą neutralizuojančių antikūnų nustatymas nevakcinuotų asmenų serume, paprastai atliekamas greituoju fluorescencinio fokusavimo slopinimo testu (RFFIT), taip pat yra diagnostinis. Antikūnų buvimas smegenų skystyje patvirtina diagnozę, tačiau jie gali pasirodyti 2–3 dienomis vėliau nei serumo antikūnai, todėl ankstyvosiose ligos stadijose gali būti mažiau naudingi. Nors serologinis atsakas po vakcinacijos paprastai nesiskiria nuo ligos sukelto serologinio atsako, vakcinacija paprastai nesukuria antikūnų smegenų skystyje.
Per pastaruosius 25 metus gerai dokumentuoti tik septyni pasiutligės „pasveikimo“ atvejai. Nors pasiutligės virusas nebuvo išskirtas iš nė vieno paciento, dideli pasiutligę neutralizuojančių antikūnų titrai serumo mėginiuose ir neutralizuojančių antikūnų buvimas smegenų skystyje tvirtai patvirtino diagnozę.
Ką reikia išnagrinėti?
Kokie testai reikalingi?
Diferencialinė diagnostika
Žmonių pasiutligės diagnozė paprastai nustatoma remiantis epidemiologiniais ir klinikiniais duomenimis ir patvirtinama laboratorijoje. Diagnozė yra paprasta, jei yra buvę gyvūnų įkandimų ir pasireiškė visas simptomų bei požymių spektras. Priešingu atveju, prieš atliekant specifinius laboratorinius tyrimus, būtina atidžiai, bet greitai įvertinti mažiau tipiškų atvejų epidemiologinius ir klinikinius požymius. Bet kurį pacientą, kuriam pasireiškia neurologiniai požymiai ar simptomai arba nepaaiškinamas encefalitas, reikėtų apklausti apie galimybę turėti kontaktą su gyvūnais pasiutligės endeminėse vietovėse gyvenamojoje šalyje ar už jos ribų. Tai, kad keliose neseniai Jungtinėse Valstijose įvykusiose žmonių mirties atvejais nebuvo įtariama pasiutligė, galėjo būti dėl to, kad nebuvo kruopščiai surinkta kontakto su gyvūnais anamnezė.
Ligos pradžioje pasiutligė gali imituoti daugelį infekcinių ir neinfekcinių ligų. Daugelis kitų encefalitų, pavyzdžiui, sukeliamų herpesvirusų ir arbovirusų, yra panašūs į pasiutligę. Kitos infekcinės ligos taip pat gali imituoti pasiutligę, pavyzdžiui, stabligė, smegenų maliarija, riketsiozė ir vidurių šiltinė. Paralyžinės infekcinės ligos, kurias galima supainioti su pasiutlige, yra poliomielitas, botulizmas ir beždžionių B encefalitas.
Neinfekcinės ligos, kurias galima supainioti su pasiutlige, apima keletą neurologinių sindromų, ypač ūminę uždegiminę polineuropatiją (Guillain-Barré sindromą), taip pat alerginį povakcininį encefalomielitą, kurį sukelia nervinio audinio pažaida po pasiutligės vakcinacijos, apsinuodijimas ar intoksikacija vaistais, alkoholio vartojimo nutraukimo sindromas, ūminė porfirija ir pasiutligės isterija. Guillain-Barré sindromą galima supainioti su paralyžine pasiutlige ir atvirkščiai.
Su kuo susisiekti?
Gydymas pasiutligė
Pasiutligės gydymas nėra sukurtas. Didelės specifinio imunoglobulino nuo pasiutligės ir leukocitų interferono dozės skyrimas yra neefektyvus. Simptominis gydymas taikomas paciento kančioms palengvinti. Šiuo tikslu pacientas paguldomas į atskirą palatą arba boksą, sukuriamas apsauginis režimas, ribojantis išorinės aplinkos įtaką (sumažintas triukšmas, ryški šviesa, oro srautas). Centrinės nervų sistemos jaudrumui sumažinti skiriami migdomieji, prieštraukuliniai ir skausmą malšinantys vaistai. Normalizuojama vandens balansas.
Paralyžinėje stadijoje skiriami vaistai, kurie stimuliuoja širdies ir kraujagyslių bei kvėpavimo sistemų veiklą. Rekomenduojama taikyti hiperbarinę oksigenaciją, smegenų hipotermiją, kontroliuojamą mechaninį kvėpavimą, visiškai išgydant pacientą. Tačiau visi gydymo metodai yra praktiškai neefektyvūs. Geriausiu atveju pavyksta pailginti paciento gyvenimą keliais mėnesiais. Nepalankią baigtį lemia smegenų kamieno pažeidimo sunkumas, sunaikinant gyvybinius centrus.
Prevencija
1885 m. Pasteuro sukurta pirmoji vakcina nuo pasiutligės pradėjo daug veiksmingesnės pasiutligės kontrolės erą. Šiandien, nepaisant beveik 100 % žmonių mirtingumo nuo pasiutligės, ligos galima visiškai išvengti skiepijant prieš ir (arba) po užsikrėtimo. Nors Pasteuras ir jo kolegos inicijavo privačių šunų vakcinaciją Paryžiuje, pirmoji masinė šunų vakcinacija buvo atlikta XX a. trečiojo dešimtmečio pradžioje Japonijoje, ir tai buvo pirmoji didelė nacionalinė pasiutligės kontrolės programa. Oralinė laukinių gyvūnų vakcinacija, pirmą kartą sukurta aštuntajame dešimtmetyje, nuo to laiko ne kartą buvo įrodyta, kad veiksmingai kontroliuoja ligą pagrindiniams sausumos šeimininkams, tokiems kaip lapės, meškėnai ir skunksai.[68] Ilgalaikė rezervuarinių gyvūnų populiacijų vakcinacija nuo pasiutligės, kurios aprėptis siekia 70 % ar daugiau, galiausiai pašalins RABV iš rezervuarinių rūšių ir užkirs kelią viruso plitimui atsitiktiniams šeimininkams.[ 69 ]
Filogenetiniai duomenys rodo, kad lisavirusai užkrėtė šikšnosparnius gerokai anksčiau nei sausumos žinduolius, ir dauguma lisavirusų, įskaitant RABV, vis dar cirkuliuoja tarp įvairių šikšnosparnių rūšių visame pasaulyje.[ 70 ] Tačiau veiksmingų RABV perdavimo tarp šikšnosparnių prevencijos metodų vis dar nėra, todėl šiuo metu neįmanoma visiškai išnaikinti pasiutligės. Tačiau net ir po sąlyčio su RABV per pasiutlige užsikrėtusio žinduolio įkandimą, saugi ir veiksminga profilaktika po ekspozicijos (PEP, įskaitant žaizdų valymą, pasiutligės imunoglobuliną ir vakcinaciją nuo pasiutligės) gali apsaugoti žmones nuo pasiutligės infekcijos, jei gydymas skiriamas nedelsiant ir laikantis Pasaulio sveikatos organizacijos (PSO) rekomendacijų.
Šie du žmonių mirčių prevencijos metodai – vienas pagrįstas užsikrėtusiųjų vakcinacija, o kitas – pakankamo šunų skaičiaus vakcinavimu, kad būtų nutrauktas perdavimo ciklas prie šaltinio – yra „vienos sveikatos“ požiūrio į šunų pasiutligės prevenciją ir kontrolę kertiniai akmenys. Šios dvi skirtingos žmonių mirčių prevencijos priemonės buvo svarstomos kaip atskiros alternatyvos: A strategija, pagrįsta PEP teikimu žmonėms, ir B strategija, pagrįsta šunų vakcinacija; arba kaip kombinuotos A + B strategijos komponentai, analizuojant galimas alternatyvių strategijų išlaidas.[ 71 ]
Tokios šalys kaip Tailandas sėkmingai užkirto kelią žmonių mirtims naudodamos PEP, tačiau taip pat pastebėjo didėjančią paklausą ir su PEP naudojimu susijusias išlaidas. [ 72 ] Pavyzdžiui, palyginti su 1991 m., 2003 m. PEP reikėjo keturis kartus daugiau žmonių (daugiau nei 400 000). Naujausi duomenys rodo, kad Kinijos Liaudies Respublika, kuri kasmet paskiepija 15 milijonų žmonių po galimo užsikrėtimo pasiutlige, vien PEP išleidžia apie 650 milijonų JAV dolerių per metus. [ 73 ]
Daug tvaresnis požiūris – užkirsti kelią infekcijos plitimui jos šaltinyje, gyvūnų populiacijoje, ir tuo pačiu metu prireikus padidinti PEP prieinamumą žmonėms, kurie buvo paveikti užsikrėtimo. Kai yra politinė valia ir tinkamas finansavimas kontroliuoti šunų pasiutligę, mirties atvejų galima ir buvo išvengta. Plačiai paplitęs šunų vakcinavimas lėmė šunų pasiutligės išnaikinimą keliose šalyse, įskaitant Malaiziją 1954 m. [ 74 ], Japoniją 1956 m., Taivaną 1961 m., Singapūrą ir ypač visoje Vakarų Europoje (apžvalga pateikta Rupprecht ir kt., King ir kt. bei Gongal ir Wright darbuose). [ 75 ]
Использованная литература


 [
[