Medicinos ekspertas
Naujos publikacijos
Hipofizės anemija (nykštukinė anemija)
Paskutinį kartą peržiūrėta: 12.07.2025

Visas „iLive“ turinys yra peržiūrėtas medicinoje arba tikrinamas, kad būtų užtikrintas kuo didesnis faktinis tikslumas.
Mes turime griežtas įsigijimo gaires ir susiejamos tik su geros reputacijos žiniasklaidos svetainėmis, akademinių tyrimų institucijomis ir, jei įmanoma, medicininiu požiūriu peržiūrimais tyrimais. Atkreipkite dėmesį, kad skliausteliuose ([1], [2] ir tt) esantys numeriai yra paspaudžiami nuorodos į šias studijas.
Jei manote, kad bet koks mūsų turinys yra netikslus, pasenęs arba kitaip abejotinas, pasirinkite jį ir paspauskite Ctrl + Enter.
Terminas „hipofizės nykštukinė liauka“ (iš graikų kalbos nanos – nykštukas; sin.: nykštukinė liauka, nanosomija, mikrosomija) absoliučia prasme reiškia ligą, kurios pagrindinė apraiška yra staigus augimo sulėtėjimas, susijęs su priekinės hipofizės augimo hormono sekrecijos sutrikimu.
Plačiąja prasme dwarfizmas yra augimo ir fizinio vystymosi sutrikimas, kurio atsiradimą gali sukelti ne tik absoliutus ar santykinis somatotropinio hormono trūkumas dėl pačios hipofizės patologijos, bet ir pagumburio (smegenų) jos funkcijų reguliavimo sutrikimas, somatotropinio hormono biosintezės defektai, audinių jautrumo šiam hormonui sutrikimai.
Priežastys nykštukinė liga
Dauguma hipofizės dwarfizmo formų yra genetinės ligos. Dažniausiai pasitaiko panhipopituitarinis dwarfizmas, kuris paveldimas daugiausia recesyviniu būdu. Manoma, kad yra 2 šios patologijos formos perdavimo tipai – autosominis ir per X chromosomą. Sergant šia dwarfizmo forma, kartu su somatotropinio hormono sekrecijos defektu, dažniausiai sutrinka gonadotropinų ir skydliaukę stimuliuojančio hormono sekrecija. AKTH sekrecija sutrinka rečiau ir mažesniu mastu. Funkciniai tyrimai su išlaisvinančiais hormonais, įskaitant sintetinį somatotropiną išlaisvinantį hormoną (susidedantį iš 29, 40 ir 44 aminorūgščių liekanų), panašų į kasos polipeptidą, parodė, kad dauguma šių pacientų turi patologiją pagumburio lygmenyje, o priekinės hipofizės nepakankamumas yra antrinis. Pirminė pačios hipofizės patologija yra retesnė.
Genetinis dwarfizmas su izoliuotu augimo hormono trūkumu, sutrikusiu biologiniu aktyvumu ir jautrumu jam, sporadiškai aptinkamas Rusijoje ir kaimyninėse šalyse. Dažniau jis pasitaiko Amerikos žemyne, Artimųjų ir Viduriniųjų Rytų šalyse bei Afrikoje. Remiantis somatotropinio hormono kiekio kraujyje ir pacientų jautrumo egzogeniniam somatotropiniam hormonui, imunoreaktyvaus insulino (IRI), į insuliną panašių augimo faktorių (IGF) I tipo (somatomedino C) ir II tipo lygio bei IGF-1 reakcijos į gydymą somatotropinio hormono preparatais tyrimo rezultatais, nustatyti įvairūs kliniškai panašių dwarfizmo tipų variantai.
Neseniai buvo iššifruota Larono dwarfizmo patogenezė, kurią sukelia IRF-1 ir IRF-II trūkumas, taip pat dwarfizmo patogenezė afrikiniams pigmėjams, susijusi su pirmojo trūkumu.
1984 m. buvo aprašytas naujas pseudohipofizės dwarfizmo variantas, pasižymintis dideliu somatotropinio hormono ir IGF-1 kiekiu; dwarfizmo atsiradimas paaiškinamas jo receptorių defektu, kurį įrodo staigus odos fibroblastų prisijungimo prie IGF-1 sumažėjimas.
Reikėtų pabrėžti, kad šiuolaikinėmis sąlygomis, esant mažoms šeimoms, daugelis pavienių („idiopatinių“, sporadinių) ligos atvejų taip pat gali būti genetiniai.
Išanalizavus 350 ligos istorijų, 228 pacientams (65,2 %) dwarfizmo etiologija nebuvo aiški. Į šią grupę buvo įtraukti pacientai iš 57 šeimų, kuriose dwarfizmas pasireiškė pakartotinai (2–4 atvejai šeimoje), tai sudarė 28 % visų pacientų. 77 % šeimų, kuriose etiologiškai neaiškios (dažniausiai genetinės) dwarfizmo formos, nustatytas neginčijamas ryšys su Rh faktoriaus nebuvimo paveldėjimu. Rh faktoriaus pasiskirstymas pacientų, sergančių dwarfizmu, šeimose skiriasi nuo to, kuris stebimas esant Rh konfliktui tarp motinos ir vaisiaus, ir, kaip taisyklė, nėra lydimas naujagimio hemolizinės ligos (tėvas gali būti Rh neigiamas, o tėvų heterozigotiškumo Rh faktoriui atveju – vaikai ir kt.). Galima daryti prielaidą apie ryšį tarp genų, atsakingų už somatotropinio hormono (arba somatotropiną atpalaiduojančio hormono) sintezę, aktyvumo ir genų, lemiančių Rh faktorių, juolab kad dauguma dwarfizmo formų ir Rh faktoriaus nebuvimas yra autosominiai recesyviniai požymiai. Tai nepaaiškina santykinio dwarfizmo retumo, palyginti su Rh neigiamų asmenų dažniu populiacijoje. Tikriausiai svarbūs ir kai kurie dar nežinomi papildomi veiksniai, tačiau Rh faktoriaus pasiskirstymo ypatybės pacientų, sergančių šeimyniniu ir sporadiniu dwarfizmu, šeimose greičiausiai nėra atsitiktinės.
Didelę pacientų, sergančių dwarfizmu (pirminiu smegenų, smegenų-hipofizės), grupę sudaro pacientai, sergantys įvairiomis centrinės nervų sistemos organinėmis patologijomis, atsiradusiomis gimdoje arba ankstyvoje vaikystėje. Anatominis substratas, sukeliantis šią patologiją, gali būti hipofizės neišsivystymas arba nebuvimas, jos distopija esant turkio spalvos plyšio formavimosi patologijai, hipofizės cistinė degeneracija, jos atrofija dėl naviko suspaudimo (kraniofaringioma, chromofobinė adenoma, meningioma, glioma). Dwarfizmą gali sukelti trauminiai hipotalamo-hipofizės srities sužalojimai (intrauterininiai, gimdymo ar postnataliniai), kurie dažnai pasireiškia daugiavaisio nėštumo metu, taip pat gimdymo metu sėdmeninėje padėtyje, pėdos pateikimo metu arba skersinėje padėtyje su sukimu ant kojos (toks gimdymo mechanizmas yra daugiau nei 1/3 pacienčių, sergančių dwarfizmu). Svarbios yra infekcinės ir toksinės žalos (intrauterininės virusinės infekcijos, tuberkuliozė, sifilis, maliarija, toksoplazmozė; ligos ankstyvame amžiuje, naujagimių sepsis, meningo ir arachnoencefalitas ir kt.). Šie procesai gali pažeisti pačią hipofizę, jos funkciją reguliuojančius pagumburio centrus ir sutrikdyti normalius funkcinius ryšius centrinėje nervų sistemoje.
Intrauterininiai vaisiaus pažeidimai gali lemti pacientų, sergančių „nykštukiniu po gimimo“ ir turinčių normalią augimo hormono sekreciją, gimimą (smegenų pirminis nykštukinis modelis, mikrocefalija, Silver-Russell nykštukinis modelis su kūno hemiasimetrija ir dideliu gonadotropinų kiekiu ir kt.).
Papildomi veiksniai, apsunkinantys fizinio vystymosi sutrikimą esant nykštukinei formai, gali būti nepakankama mityba, nesubalansuota esminių ingredientų (baltymų trūkumas) ir mikroelementų (cinko trūkumas) atžvilgiu, nepalankios aplinkos sąlygos, taip pat įvairios lėtinės ligos, tokios kaip glomerulonefritas, kai azotemija veikia kepenų receptorių aktyvumą arba tiesiogiai veikia kepenų ląstelių metabolizmą, sukeldama somatomedino sintezės sumažėjimą arba kepenų cirozę, kai sutrinka somatomedino susidarymas.
Pathogenesis
Daugumai pacientų, sergančių hipofizės nykštukiniu augimu, pokyčiai neapsiriboja somatotropinio hormono sekrecijos patologija ir jautrumu jam, bet apima ir kitus hipofizės tropinius hormonus, kurie sukelia įvairius endokrininių ir medžiagų apykaitos sutrikimų derinius.
Esant izoliuotam somatotropinio hormono trūkumui, hipofizės morfologiniai pokyčiai buvo menkai ištirti. Tirtais atvejais patologiniai sutrikimai (kraniofaringioma arba kaukolės kaulų hiperostozė) buvo reti. Šio tipo dwarfizme gali būti stebimas įgimtas peptiderginių ląstelių neišsivystymas arba neurotransmiterių sistemos defektas pagumburyje. Tokiais atvejais dwarfizmas gali būti derinamas su regos nervų displazija arba hipoplazija. Intraseliarinės cistos, hipofizės ir pagumburio navikai sukelia STH trūkumą, sukeldami hipofizės audinio, ypač somatotrofų, suspaudimą.
Nykštukinei formai būdingas kaulų retėjimas, daugiausia dėl žievinio sluoksnio, uždelsta skeleto diferenciacija ir kaulėjimas. Vidaus organai yra hipoplastiniai, kartais atrofiniai, raumenys silpnai išsivystę.
Simptomai nykštukinė liga
Staigus augimo ir fizinio vystymosi atsilikimas yra pagrindinės hipofizės nykštukiškumo apraiškos. Pacientai gimsta normalaus kūno svorio ir ūgio, o augimas pradeda atsilikti nuo 2–4 metų amžiaus.
Prieš atsirandant aktyviam nanizmo gydymui, nykštukais buvo laikomi tie, kurių ūgis mažesnis nei 120 cm moterims ir 130 cm vyrams. Šiuo metu nykštuko ūgis skiriasi bent 2–3 sigma nuokrypiais nuo vidutinės lentelės normos tam tikrai lyčiai, amžiui ar populiacijai. Taip pat yra grafinio ūgio įvertinimo metodas, pagrįstas Gauso pasiskirstymo kreive. Šiuo atveju nykštukai pagal ūgį įtraukiami į grupę, kuri apima minimalų individų skaičių atitinkamoje populiacijoje, turinčią didžiausią atsilikimą nuo vidutinės augimo normos.
Hipofizės dwarfizmui būdingas ne tik mažas absoliutus kūno dydis, bet ir maža metinio augimo bei fizinio vystymosi dinamika. Kūno sudėjimas proporcingas, tačiau pacientų kūno proporcijos būdingos vaikystei. Oda blyški, dažnai gelsvo atspalvio, sausa, tai lemia absoliutus arba santykinis skydliaukės nepakankamumas, kartais stebima cianozė – odos „marmuravimas“. Negydomiems pacientams anksti atsiranda senstanti ir raukšlėta oda (geroderma). Taip yra dėl nepakankamo STH anabolinio veikimo ir lėtos ląstelių kartų kaitos.
Galvos plaukai gali būti normalūs arba sausi, ploni, lūžinėjantys; būdingos ilgos blakstienos. Antrinio plaukų augimo dažnai nebūna. Daugumai pacientų, sergančių dwarfizmu (70–75 %), turkio spalvos mušelės dydis nepasikeičia, tačiau mušelė dažnai išlaiko vaikišką „stovinčio ovalo“ formą, turi plačią „jaunystės“ nugarėlę, sfenoidinio kaulo sinusas atsilieka pneumatizacijos požiūriu. Tačiau pasitaiko pacientų, kuriems padidėjusi turkio spalvos mušelė yra naviko požymis; jos fone arba įėjimo srityje yra kalcifikacijos sričių (su kraniofaringioma, neuroinfekcijos liekamasis poveikis) arba ji yra sumažėjusi (neišsivystymo požymiai, mažas hipofizės dydis). Pastebimi intrakranijinės hipertenzijos simptomai: kaukolės skliauto kaulų retėjimas, padidėjęs kraujagyslių raštas, pirštų atspaudų buvimas ir kt. Svarbiausias hipofizės dwarfizmo požymis yra skeleto diferenciacijos ir kaulėjimo laiko vėlavimas. Su skeleto diferenciacija glaudžiai susiję ir dantų sistemos ypatumai: pastebimas vėlyvas pieninių dantų pasikeitimas. Didžiausias skeleto sistemos vystymosi atsilikimas stebimas pacientams, sergantiems nykštukiniu augimu, turinčiais lytinio nepakankamumo ir hipotirozės požymių.
Daugelio pacientų lytiniai organai yra labai neišsivystę, nors apsigimimai reti. Kriptorchidizmą stebėjome 5,8 % vyrų pacientų. Lytinį nepakankamumą lydi antrinių lytinių požymių neišsivystymas ir sumažėjęs lytinis potraukis, menstruacijų nebuvimas. Normalus savaiminis lytinis vystymasis stebimas tik pacientams, kuriems yra izoliuotas augimo hormono trūkumas, ir kai kuriems pacientams, sergantiems smegenų nykštukiniu augimu.
Skydliaukės nepakankamumas yra gana dažnas nykštukinės liaukos simptomas. Reikėtų atkreipti dėmesį, kad išorinės hipotirozės apraiškos ne visada atspindi tikrąją skydliaukės funkcinę būklę. Taip yra dėl santykinės hipotirozės dėl sutrikusio tiroksino (T4) virsmo trijodtironinu (T3 ) ir neaktyvaus (grįžtamojo)T3 susidarymo, kuris būdingas somatotropiniam nepakankamumui.
Adrenokortikotropinė funkcija hipofizės nykštukinėje formoje mažėja rečiau ir mažesniu mastu nei lytinės ir skydliaukę stimuliuojančios funkcijos, todėl daugumai pacientų specialios korekcijos nereikia.
Daugeliu atvejų intelektas nėra sutrikęs. Pasitaiko emocinių pokyčių, pasireiškiančių protiniu infantilizmu; vyresnio amžiaus pacientams, neturintiems intelekto sutrikimų, kartais stebimos reaktyviosios neurozės.
Sergant organine smegenų patologija, ypač naviko pobūdžio, gali pasireikšti nykštukinė forma su diabeto insipidus, bitemporinės hemianopsijos ir intelekto sutrikimų simptomais.
Tyrimas, skirtas smegenų bioelektrinio aktyvumo raidai pacientams, neturintiems organinių centrinės nervų sistemos simptomų, parodė, kad jų EEG būdingi nebrandumo požymiai, ilgalaikis aukštos „vaikiškos“ EEG įtampos išsaugojimas; alfa ritmo amplitudės ir dažnio netolygumas; staigus lėtų θ ir δ ritmų kiekio padidėjimas, ypač priekinėje ir centrinėje laiduose; ryški reakcija į hiperventiliaciją; EEG ritmų diapazono poslinkis po šviesos stimuliacijos ritmų link žemų dažnių (smegenų nervinių struktūrų funkcinio mobilumo sumažėjimo įrodymai). Nustatyta, kad vyresnio amžiaus pacientams smegenų elektrinio aktyvumo nesubrendimas atsiranda dėl lytinio neišsivystymo, o visų amžiaus grupių pacientams – dėl hipotirozės.
Pacientų, sergančių dwarfizmu, angliavandenių apykaitai būdingas polinkis mažinti gliukozės kiekį kraujyje nevalgius, padidėjimas fizinio krūvio metu, endogeninio insulino nepakankamumas, padidėjęs jautrumas egzogeniniam insulinui, dažnai išsivystant hipoglikeminėms būklėms. Pastaroji daugiausia paaiškinama nepakankamu priešuždegiminių hormonų kiekiu pacientų organizme.
Vidaus organuose pastebima splanchnomikrija, t. y. jų dydžio sumažėjimas. Nėra aprašyta jokių funkcinių vidaus organų pokyčių, būdingų dwarfizmui. Dažnai stebima arterinė hipotenzija su sumažėjusiu sistoliniu ir diastoliniu spaudimu bei sumažėjusia pulso amplitude. Širdies garsai duslūs, girdimi įvairių temų funkciniai ūžesiai dėl trofinių miokardo pokyčių ir autonominės nervų sistemos sutrikimų. EKG būdingas žemas pulsas (ypač esant hipotireozei), sinusinė bradikardija arba bradiaritmija; PCG rodo tonų amplitudės sumažėjimą, papildomus tonus ir funkcinius ūžesius. Oksigemometrijos duomenys rodo hipoksemiją (pradinę ir fizinio krūvio metu) ir deguonies skolą. Senyvo amžiaus pacientams kartais išsivysto hipertenzija.
Diagnostika nykštukinė liga
Dwarfizmo diagnozė ir diferencinė diagnozė grindžiama anamnezės duomenimis ir išsamiais klinikiniais, radiologiniais, laboratoriniais bei hormoniniais tyrimais. Be absoliutaus kūno dydžio, pacientų augimui įvertinti nustatomas augimo deficitas – skirtumas tarp paciento ūgio ir jo vidutinės normos atitinkamai lyčiai ir amžiui; augimo amžius – paciento ūgio atitikimas tam tikriems standartams; normalizuoto nuokrypio rodiklis.
I = M - Mcp / δ, kur M yra paciento ūgis, Mcp yra vidutinis normalus ūgis tam tikrai lyčiai ir amžiui, δ yra kvadratinis nuokrypis nuo Mcp; I mažesnis nei 3 būdingas nanizmui, I didesnis nei 3 – gigantizmui. Šis rodiklis gali būti naudojamas vystymosi dinamikai įvertinti.
Rentgeno tyrimas pacientams, sergantiems dwarfizmu, atskleidžia intrakranijinės hipertenzijos požymius, neuroinfekcijos liekamąjį poveikį, kalcifikacijas ir kraniosinostozę. Turkio spalvos sruogos dydžio, formos ir struktūros tyrimas laikomas netiesioginiu rodikliu, apibūdinančiu hipofizės dydį. Viena iš svarbiausių patologinio augimo sulėtėjimo apraiškų yra skeleto diferenciacijos sutrikimas. Norint įvertinti skeleto brandos laipsnį, nustatomas kaulų (radiografinis) amžius, kuris atitinka kaulinio audinio diferenciaciją; kaulėjimo nepakankamumas yra kaulėjimo atsilikimo nuo normos laipsnis (metais), kaulėjimo koeficientas yra kaulų amžiaus padalos iš chronologinių ir kitų parametrų dalmuo.
Šiuolaikinė dwarfizmo diagnostika neįmanoma neištyrus somatotropinio hormono sekrecijos, jo bazinio lygio, paros ritmo ir išsiskyrimo stimuliuojant. Daugumai pacientų, sergančių hipofizės dwarfizmu, būdingas sumažėjęs somatotropinio hormono kiekis kraujo serume. Radioimunologiniu metodu nustatytas kiekis (pagal skirtingus autorius) yra nuo (0,87±0,09) iki (1,50±0,64) ng/ml, o vidutinė norma yra (3,81±0,29) ng/ml. Somatotropinio hormono sekrecijos paros (cirkadinio) ritmo tyrimas parodė, kad sveikų žmonių organizme jo kiekis didžiausias per pirmąsias 2 miego valandas ir 4–6 val. ryto. Sergant dwarfizmu, somatotropinio hormono kiekis šiomis valandomis taip pat sumažėja.
Somatotropinės funkcijos rezervams tirti naudojami įvairūs stimuliatoriai, stebint somatotropinio hormono kiekį prieš ir po jų įvedimo. Kraujas tyrimui imamas kas 30 minučių 2–3 valandas. Somatotropinio hormono išsiskyrimas po stimuliacijos laikomas normaliu, kai jo kiekis ne mažesnis kaip 7–10 ng/ml, kartais jis siekia 20–40 ng/ml. Jei viename iš mėginių reakcijos nėra, atliekami pakartotiniai tyrimai su kitais stimuliatoriais. Somatotropinio hormono nepakankamumas laikomas įrodytu, jei somatotropinio hormono neišsiskiria 2–3 skirtinguose mėginiuose.
Dažniausiai naudojami stimuliuojantys testai yra šie: į veną suleidus 0,1 U (0,75–1,5 U) insulino 1 kg paciento kūno svorio ir pasiekus hipoglikemiją (gliukozės kiekio kraujyje sumažėjimą 50 %, palyginti su pradiniu lygiu), somatotropinio hormono kiekis serume nustatomas pagal aukščiau pateiktą schemą. Jei išsivysto sunki hipoglikemija, testas nutraukiamas ir pacientui į veną suleidžiama gliukozė. Tai yra labiausiai paplitęs, klasikinis diagnostikos metodas.
TRH 200–500 mcg dozė į veną. Efektyviai nustato hormonų atsargas, nesukelia komplikacijų. Kartu su insulino tyrimu leidžia įvertinti pagumburio-hipofizės sistemos pažeidimo lygį. Teigiama reakcija į TRH, kai nėra insulino, sukelia hipoglikemiją, rodo hipofizės nepažeistumą ir pažeidimą pagumburio lygmenyje, neigiamos reakcijos į TRH ir hipoglikemiją rodo pačios hipofizės pažeidimą.
TRH, LH-RH, leidžiamas į veną 300 mcg doze, yra panašus į ankstesnį.
Žmogaus SGH yra sintetinis biologiškai aktyvaus junginio, išskirto iš kasos naviko, analogas. Šiuo metu yra 3 sintetinio SGH tipai: su 29, 40 ir 44 aminorūgščių liekanomis. Jis leidžiamas į veną nuo 1 iki 3 μg/kg paciento kūno svorio dozėmis. STH išsiskyrimas stebimas praėjus 15–20 minučių po vartojimo, šis testas yra efektyvesnis nei kiti nustatant endogeninio augimo hormono atsargas. Teigiama SGH reakcija rodo pagumburio somatotropinės funkcijos pažeidimo lygį ir nepažeistą hipofizę; su aminorūgštimis (L-arginino monochloridu, ornitinu, triptofanu, glicinu, leucinu) leidžiama į veną 0,25–0,5 g 1 kg paciento kūno svorio doze. Veiksmingas tiriant SGH atsargas. Gali sukelti alergines reakcijas.
L-dopa geriama per burną 250–500 mcg doze. Veiksminga, pacientai gerai toleruoja.
Taip pat naudojami testai su gliukagonu, bromo ergokriptinu (parlodel), lizino vazopresinu, klonidinu ir dozuotu veloergometriniu krūviu.
Somatotropinės funkcijos būklės tyrimas yra būtinas ne tik nykštukinės gimsties diagnozei, bet ir pagrįstam gydymo metodo pasirinkimui, nes gydymas somatotropinu yra racionalus tik esant endogeninio augimo hormono nepakankamumui.
Dwarfizmo formai diagnozuoti labai svarbu ištirti insulino tipo augimo faktorių, arba somatomedinų (ypač IGF-1 arba somatomedino C), – somatotropinio hormono veikimo audinių lygmenyje tarpininkų, – kiekį. Yra žinoma, kad sergant dwarfismu somatomedino C kiekis yra sumažėjęs, o sergant akromegalija – padidėjęs, palyginti su norma. Larono aprašyta dwarfizmo forma yra ligos rūšis, kai STH gamyba normali, bet su IGF-1 ir IGF-II susidarymo sutrikimu. Tokių pacientų gydymas somatotropinu yra beprasmis.
Netiesioginiai hipofizės somatotropinės funkcijos rodikliai yra šarminės fosfatazės aktyvumas ir neorganinio fosforo kiekis serume. Hiposomatotropinėmis sąlygomis šie rodikliai yra sumažėję. Sergant panhipofizine dwarfizmo forma, sumažėja gonadotropinų, dažnai TSH, sekrecija, o tai lydi atitinkamas lytinių liaukų (androgenų arba estrogenų trūkumas), skydliaukės (T3 , T4 , su baltymais surišto jodo - PBI - kiekio sumažėjimas, 131I kaupimasis skydliaukėje) ir antinksčių (kortizolio ir 17-OCS kiekio sumažėjimas plazmoje, 17-KC ir 17-OCS išsiskyrimas su šlapimu, limfocitozė) funkcijų sumažėjimas.
Visiems hipofizės (hipotalaminio-hipofizio) genetinio nykštukiškumo tipams būdingas pasikartojantis vaikų susirgimas šeimoje, paveldimas autosominiu recesyviniu (dažniau) arba autosominiu dominantiniu tipu, augimo sulėtėjimas ir fizinis vystymasis nuo 2-4 metų, atsiliekant bent 2-3° nuo vidutinių augimo normų tam tikrai lyčiai, amžiui, populiacijai, esant mažam savaiminiam metiniam augimo dinamikai, uždelstam kaulėjimui. Esant mažam somatotropinio hormono kiekiui (2-3 stimuliuojančių testų metu mažesnis nei 7 ng/ml), terapija somatotropiniu hormonu yra labai veiksminga (per metus padidėja bent 7 cm ūgis). Esant normaliam arba aukštam somatotropinio hormono kiekiui (su biologiniu neaktyvumu), galima išsaugoti jautrumą hormonui. Intelekto pokyčių nepastebėta.
Esant genetiniam dwarfizmui, kai audiniai nejautrūs somatotropiniam hormonui, klinikinis vaizdas panašus į izoliuoto augimo hormono trūkumo, tačiau somatotropino terapija yra neefektyvi. Šioje grupėje pagal IRF lygį galima išskirti šias pagrindines formas: su normaliu kiekiu (IRF receptorių defektas) ir sumažėjusį – Larono tipo dwarfizmą (IRF-1 ir IRF-II trūkumas) bei afrikiniams pigmėjams būdingą tipą (IRF-1 trūkumas).
Smegenų nykštukinei formai būdingos izoliuotos šeimos ligos, susijusios su intrauterininiu ar postnataliniu centrinės nervų sistemos pažeidimu, esant akivaizdiems organiniams centrinės nervų sistemos pokyčiams, dažnai derinamiems su regos organo patologija, diabeto insipidus buvimu, gonadotropinių funkcijų išsaugojimu ir intelekto pokyčiais.
Kai kuriems lytinių liaukų disgenezės ir agenezės tipams būdingas ryškus žemas ūgis, ypač Šereševskio-Turnerio sindromas ir sėklidžių disgenezės sindromo „Turneroidinė“ (mozaikinė) forma. Citogenetiniai tyrimai (lyties chromatinas, kariotipas) padeda diferencinėje diagnostikoje, atskleidžiant chromosomų defektus, taip pat būdingus somatinio ir lytinio vystymosi defektus, normalų arba padidėjusį endogeninio somatotropinio hormono kiekį ir nejautrumą gydymui somatotropinu.
Tarp endokrininių sutrikimų, atsirandančių esant žemam ūgiui, reikėtų išskirti pirminį hipotirozę, kurią sukelia įgimta skydliaukės hipoplazija arba aplazija, jos distopija, fermentiniai skydliaukės hormonų biosintezės defektai, ankstyvas autoimuninis skydliaukės pažeidimas. Visomis šiomis ligomis vyrauja hipotirozės požymiai, kai didelis TSH kiekis, sumažėjęs T4 ir T3 kiekis serume . Autoimuninės genezėsmiksedemos atveju kraujyje aptinkami antikūnai prieš tireoglobuliną, skydliaukės audinio mikrosomines ir branduolines frakcijas, somatotropinio hormono kiekis yra normalus arba sumažėjęs. Klinikinis poveikis gali būti pasiektas kompensuojant tik hipotirozę.
Žemas ūgis lydimas priešlaikinio lytinio vystymosi ir adrenogenitalinio sindromo dėl ankstyvo augimo zonų uždarymo; Itsenko-Kušingo liga, kuri atsiranda vaikystėje dėl gliukokortikoidų slopinamojo poveikio somatotropinio hormono sekrecijai ir jų katabolinio poveikio; Mauriaco sindromas - pacientų, sergančių sunkia insulino priklausomu cukriniu diabetu, žemas ūgis ir infantilizmas.
Hipofizės nykštukinį vystymąsi reikia atskirti nuo somatogeninio fizinio vystymosi atsilikimo, kurį sukelia lėtiniai medžiagų apykaitos sutrikimai (kepenų, inkstų, virškinamojo trakto ligos), lėtinė hipoksija (širdies ir kraujagyslių bei kvėpavimo takų ligos, anemija); sisteminės raumenų ir kaulų sistemos ligos (chondrodistrofija, osteogenezės defektas, egzostozė) ir kt.
Funkcinis (konstitucinis) augimo sulėtėjimas kartais stebimas vėlyvo brendimo metu, net ir iš pažiūros sveikiems paaugliams; nustatėme, kad jis pirmiausia susijęs su laikinu gonadotropinio aktyvumo nepakankamumu. Somatotropinio hormono sekrecija paprastai nesutrinka arba yra šiek tiek sumažėjusi. Gonadotropinų stimuliavimas gali paspartinti tiek lytinį vystymąsi, tiek augimą.
Žemas šeimos pobūdžio ūgis turėtų būti laikomas fiziologinio vystymosi variantu.
Ką reikia išnagrinėti?
Kaip patikrinti?
Kokie testai reikalingi?
Su kuo susisiekti?
Gydymas nykštukinė liga
Nykštukinės liaukos gydymas yra ilgas procesas. Tai verčia gydytoją paskirstyti augimo poveikio priemones laikui bėgant, kad būtų pasiektas didžiausias klinikinis poveikis, laikantis 2 pagrindinių principų:
- maksimalus gydymo sukelto vystymosi priartinimas prie fiziologinių sąlygų;
- tausojant epifizines augimo zonas.
Ilgametė dwarfizmo gydymo patirtis leidžia manyti, kad tinkama yra ši etapinės terapijos schema. Suaugusiems pacientams dwarfizmo diagnozė paprastai nekelia abejonių. Mažiems vaikams, jei klinikinis vaizdas neaiškus, būtinas diagnostinis laikotarpis: 6–12 mėnesių stebėjimas be hormonų terapijos. Šiuo laikotarpiu skiriamas kompleksinis bendras stiprinamasis gydymas; tinkama mityba, padidinant gyvūninių baltymų, daržovių ir vaisių kiekį maiste, vitaminų A ir D, kalcio ir fosforo preparatų. Pakankamų augimo ir fizinio vystymosi pokyčių nebuvimas šiame fone ir endokrininių sutrikimų nustatymas tyrimo metu yra pagrindas pradėti hormonų terapiją.
Pagrindinis hipofizės dwarfizmo patogenetinės terapijos tipas yra žmogaus augimo hormono vartojimas, nes dauguma dwarfizmo atvejų neabejotinai priklauso nuo vienos ar kitos jo trūkumo formos. Dėl šio hormono rūšies specifiškumo žmonėms aktyvus tik žmogaus ir primatų somatotropinas. Klinikoje plačiai naudojamas vaistas, išskirtas iš žmonių, mirusių nuo neinfekcinių ir nenavikinių ligų, hipofizės. Žmogaus somatotropinas gaunamas bakterijų sintezės būdu, naudojant Escherichia coli genų inžinerijos būdu. Žmogaus somatotropinas taip pat sintetinamas cheminiu būdu, tačiau jis yra labai brangus ir praktiškai nenaudojamas klinikoje. Somatotropino gydymui atrenkami pacientai, kuriems nustatytas endogeninio augimo hormono trūkumas, o skeleto diferenciacija neviršija 13–14 metų amžiaus žmonėms būdingo lygio. Gydymui nėra amžiaus apribojimų.
Minimalios veiksmingos dozės, kurias galima vartoti pirmuoju gydymo laikotarpiu, yra 0,03–0,06 mg/kg kūno svorio. Veiksmingiausios dozės yra 2–4 mg 3 kartus per savaitę. Vienkartinės dozės padidinimas iki 10 mg nebuvo susijęs su pakankamu augimo efekto padidėjimu, tačiau sukėlė greitą antikūnų prieš somatotropiną susidarymą.
Mūsų šalyje žmogaus augimo hormono tyrimai atliekami nuo 1960 m. Buvo išbandyti du gydymo režimai: nepertraukiamas ir protarpinis, kurių kursai trunka 2–3 mėnesius ir tarp jų daromi tokie patys intervalai. Vidutinis pacientų ūgio padidėjimas per pirmuosius gydymo metus buvo 9,52 ± 0,39 cm, kūno svorio padidėjimas – 4,4 ± 0,14 kg. Taikant ilgalaikį nepertraukiamą gydymą, vidutinis ūgio padidėjimas buvo 0,82 cm/mėn., kūno svorio – 0,38 kg/mėn.; taikant protarpinį gydymą – atitinkamai 0,75 cm/mėn. ir 0,4 kg/mėn. Nuolatinis gydymas užtikrino spartesnį ūgio padidėjimą, o poveikis smarkiai sumažėjo po 1–1,5 metų, o taikant protarpinį gydymą, veiksmingumas išliko 3–4 metus, todėl kursinį gydymo režimą galima laikyti tinkamesniu. IGF-I (somatomedino C) lygio nustatymas gali būti patikimas paciento jautrumo gydymui somatotropino vaistais rodiklis. Padidėjęs IGF-I kiekis po somatotropinio hormono įvedimo leidžia numatyti teigiamą gydymo poveikį. Svarbus somatotropino gydymo privalumas yra tai, kad skeleto osifikacija nepagreitėja jo fone.
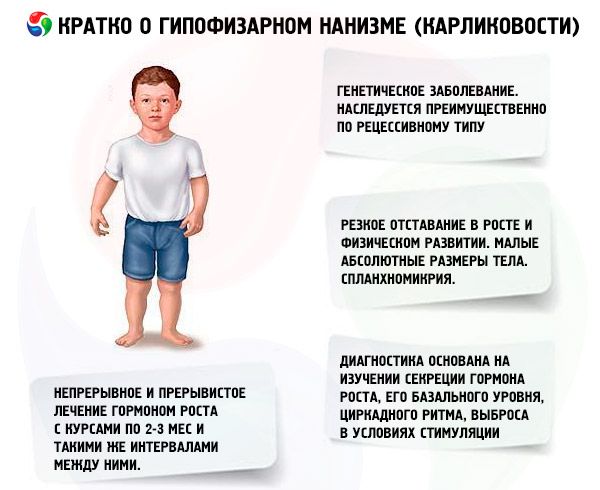
Svarbiausia dwarfizmo gydymo priemonė yra anabolinių steroidų vartojimas, kurie skatina augimą, stiprindami baltymų sintezę ir didindami endogeninio somatotropinio hormono kiekį. Gydymas atliekamas kelerius metus, palaipsniui keičiant vienus vaistus kitais, nuo mažiau aktyvių prie aktyvesnių junginių. Anabolinių vaistų keitimas nurodomas, kai po 2–3 metų sumažėja augimo poveikis, o tai lemia papildomą augimo padidėjimą. Gydymas atliekamas kursais (poilsio laikotarpis turėtų būti pusė gydymo laikotarpio). Priklausomybės atveju taip pat nurodomos ilgesnės pertraukos (iki 4–6 mėnesių). Vienu metu skiriamas tik vienas iš anabolinių steroidų. Dviejų ar daugiau vaistų derinimas yra netinkamas, nes tai nesustiprina jų metabolinio ir augimo poveikio. Pastarasis pirmiausia priklauso nuo pacientų amžiaus ir skeleto kaulų diferenciacijos laipsnio gydymo pradžioje. Geriausias poveikis pastebimas pacientams iki 16–18 metų, kurių skeleto kaulėjimas neviršija 14 metų amžiaus būdingo lygio. Patartina pradėti gydymą iškart po diagnozės nustatymo, paprastai nuo 5–7 metų amžiaus. Prieš gydymą būtina vengti skirti gonadotropinų ir lytinių hormonų, kurie, skatindami augimą, tuo pačiu metu spartina skeleto diferenciaciją. Anabolinių steroidų dozavimo principas yra nuo minimalių veiksmingų dozių iki palaipsniui didinamų. Rekomenduojamos dažniausiai vartojamų vaistų dozės: nerobolis (metandrostenolis, dianabolis) – 0,1–0,15 mg 1 kg kūno svorio per parą per burną; nerobolilis (durabolinas) – 1 mg 1 kg kūno svorio per mėnesį į raumenis, mėnesio dozė skiriama atitinkamai 2–3 dozėmis po 15 arba 10 dienų; retabolilis (deka-durabolinas) – 1 mg 1 kg kūno svorio kartą per mėnesį į raumenis. Viršijus nurodytas dozes, gali pasireikšti androgenizacija. Fiziologinėmis dozėmis šie junginiai reikšmingai neįtakoja lytinių organų būklės ir skeleto kaulų diferenciacijos, todėl juos galima ilgą laiką vartoti abiejų lyčių pacientams. Mergaites turėtų prižiūrėti ginekologas, nes perdozavus arba padidėjus individualiam jautrumui kai kuriems pacientams gali pasireikšti virilizacijos požymiai, kurie greitai išnyksta nutraukus gydymą. Geriamieji vaistai, metilinti iki etilinto 17-oje padėtyje, kartais gali sukelti cholestazinį poveikį, todėl sergant kepenų ligomis pirmenybė turėtų būti teikiama parenteraliniams anaboliniams junginiams arba geriamuosius vaistus reikia derinti su cholereticiniais vaistais. Labai retai gydymas anaboliniais steroidais gali sukelti alergines reakcijas (niežulį, bėrimą). Nesant komplikacijų, anaboliniai steroidai vartojami tol, kol stebimas augimo efektas (iki 16-18 metų, o kartais ir ilgiau). Gydymas atliekamas taikant bendrą stiprinimo terapiją.
Jei pacientams pasireiškia hipotirozės požymiai, skydliaukės vaistai (tiroksinas, tiroidinas, tirotomas) skiriami vienu metu individualiai parinktomis dozėmis.
Gydant berniukus, kitas žingsnis yra žmogaus chorioninio gonadotropino skyrimas. Šis vaistas vartojamas ne anksčiau kaip 15–16 metų, o dažnai ir dar vėlesniame amžiuje, siekiant stimuliuoti Leidigo ląsteles, o tai pagreitina tiek lytinį vystymąsi, tiek augimą (dėl jų pačių androgenų anabolinio aktyvumo). 1000–1500 TV dozės vartojamos 1–2 kartus per savaitę į raumenis 2 mėnesių kursais ne daugiau kaip 2–3 kartus per metus. Jei poveikis nepilnas, gydymas žmogaus chorioniniu gonadotropinu 16 metų ir vyresniems berniukams kaitaliojamas su mažų androgenų dozių skyrimu (metiltestosterono 5–10 mg/d. doze po liežuviu).
Mergaitės, vyresnės nei 16 metų, gali pradėti gydymą mažomis estrogenų dozėmis, imituojančiomis normalų lytinį ciklą. Gydymas atliekamas 3 savaites per mėnesį, po to daroma pertrauka. Antroje ciklo fazėje, nuo 3 savaitės, galima skirti chorioninį gonadotropiną 1000–1500 TV doze 3–5 kartus per savaitę arba vaistus, turinčius progestogeninį poveikį (pregniną, progesteroną).
Paskutinis gydymo etapas (uždarius augimo zonų gynimo priemones) – nuolatinis gydomųjų lytinių hormonų dozių, atitinkančių paciento lytį, skyrimas, siekiant visapusiškai išsivystyti lytiniams organams, antriniams lytiniams požymiams, užtikrinti libido ir lytinę potenciją. Moterims gydyti patogūs kombinuoti estrogenų-progestogenų preparatai (non-ovlonas, bisekurinas, infekundinas, rigevidonas), o vyrams – pailginto atpalaidavimo androgenų preparatai (testenatas, sustanonas-250, omnadrenas-250).
Atliekamas bendras stiprinamasis gydymas (režimas, baltymų ir daržovių dieta, vitaminų terapija, biostimuliantai). Nurodytas cinko preparatų vartojimas, kurių veikimo mechanizme pagrindinis vaidmuo tenka IGF-1 (insulino tipo augimo faktoriaus I) aktyvumo didinimui.
Esant organinei centrinės nervų sistemos patologijai, taikoma priešuždegiminė, rezorbcinė ir dehidratacijos terapija. Tikslinė sisteminė terapija duoda teigiamą poveikį. Ilgalaikio etapais taikyto gydymo dėka 148 (80,4 %) iš 175 abiejų lyčių pacientų, sergančių dwarfizmu, pavyko pasiekti daugiau nei 130 cm ūgį, 92 (52,5 %) – daugiau nei 140 cm, o 32 (18,3 %) – 150–160 cm ar didesnį. Tuo pačiu metu 37 pacientai (21,2 %) padidino ūgį 30 cm, 107 (61,1 %) – 31–50 cm, o 31 (17,7 %) – 51–60 cm ar daugiau.
Prognozė
Prognozė priklauso nuo dwarfizmo formos. Esant genetiniams dwarfizmo tipams, gyvenimo prognozė yra palanki. Esant hipofizės navikui ir organinei centrinės nervų sistemos pažeidimui, ją lemia pagrindinio patologinio proceso vystymosi dinamika. Šiuolaikiniai gydymo metodai žymiai padidino pacientų fizinius gebėjimus ir darbingumą, pailgino jų gyvenimo trukmę. Aktyvaus gydymo laikotarpiu pacientus reikia apžiūrėti pas gydytoją kas 2–3 mėnesius, palaikomojo gydymo metu – kas 6–12 mėnesių.
Pacientų socialinei adaptacijai nepaprastai svarbus jų užimtumas, atitinkantis jų intelektines ir fizines galimybes.
Patartina rinktis profesijas, kurios nėra susijusios su dideliu fiziniu krūviu, bet leidžia pademonstruoti intelektinius gebėjimus, gebėjimą atlikti tikslų darbą ir kalbas.


 [
[